题目内容
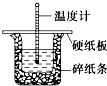 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(4)实验中改用60mL 0.50mol?L-1盐酸跟50 mL 0.55mol?L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
(6)平行地做一次这样的实验需要测定
考点:中和热的测定
专题:实验题
分析:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
(5)根据弱电解质电离吸热分析;
(6)需测3次温度,即测量盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度.
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
(5)根据弱电解质电离吸热分析;
(6)需测3次温度,即测量盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度.
解答:
解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是隔热,故答案为:隔热;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50mol?L-1盐酸代替H2SO4溶液进行上述实验,测得中和热数值相等,
故答案为:不相等;相等;因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于中和热数值;
CH3COOH溶液为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;偏小;
(6)实验要盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度,至少需要测量3次,故答案为:3.
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是隔热,故答案为:隔热;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50mol?L-1盐酸代替H2SO4溶液进行上述实验,测得中和热数值相等,
故答案为:不相等;相等;因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于中和热数值;
CH3COOH溶液为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;偏小;
(6)实验要盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度,至少需要测量3次,故答案为:3.
点评:本题考查了中和热的测定方法、计算、误差分析,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
有A、B两种混合粉末,质量分别为m1、m2.A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成.将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg.下列说法正确的是( )(已知:KHCO3+HCl→KCl+CO2↑+H2O,NaHCO3+HCl→NaCl+CO2↑+H2O)
| A、m1=m2 |
| B、混合物A中CaCO3和KHCO3质量比一定为1:1 |
| C、25m1=21m2 |
| D、混合物B中MgCO3和NaHCO3质量比可为任意比 |
如图为反应N2+3H2?2NH3的速率V(N2)变化的图象,则横坐标不可能是( )


| A、反应时间 |
| B、温度 |
| C、压强 |
| D、N2的浓度 |
在铁和氧化铁混合物15g中,加入稀硫酸150mL,能发出H21.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol?L-1的NaOH溶液200mL,则硫酸的物质的量浓度是( )
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
 ①实验室制氧气时,应选用的发生装置是
①实验室制氧气时,应选用的发生装置是