题目内容
13.用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,下列操作使测定结果偏低的( )| A. | 滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| B. | 锥形瓶沾有少量水 | |
| C. | 以甲基橙作指示剂 | |
| D. | 滴定前仰视滴定管读数,滴定后平视刻度读数 |
分析 根据酚酞在碱性变色范围内变色以及根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$来分析.
解答 解:A、滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失,NaOH溶液体积偏多,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,c(待测)偏高,故A错误;
B、锥形瓶沾有少量水,待测液的物质的量不变,NaOH溶液体积不变,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,c(待测)不变,故B错误;
C、甲基橙在酸性变色范围变色,变色范围是3.1-4.4,滴定终点时溶液呈酸性,NaOH溶液体积偏少,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,c(待测)偏低,故C正确;
D、滴定前仰视滴定管读数,滴定后平视刻度读数,NaOH溶液体积偏小,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,c(待测)偏小,故D正确;
故选CD.
点评 本题考查中和滴定的误差分析,注意利用公式来分析解答,无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;其标准溶液的体积偏大,那么测得的物质的量的浓度也偏大,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知:相同温度下Ka(HF)>Ka(HCN).现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是( )
| A. | 溶液pH:NaF>NaCN | B. | n1>n2 | ||
| C. | H2O的电离程度:NaF>NaCN | D. | c(F-)<c(CN-) |
3.现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 过滤 萃取 分液 | B. | 萃取 分液 蒸馏 | C. | 分液 蒸馏 萃取 | D. | 萃取 蒸馏 分液 |
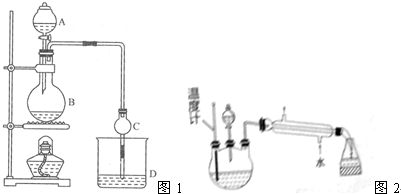
1.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含18O)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯

8.某课外兴趣小组用0.10mol•L-1标准盐酸滴定某NaOH溶液的浓度,用酚酞作指示剂.
①滴定终点时的现象为锥形瓶中的溶液由红色变无色且在半分钟内不恢复;
②滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化;
③下列操作可能使测定结果偏低的是C.
A.酸式滴定管在装酸液前未用标准酸液润洗
B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失
C.装待测液的滴定管,放液前平视,后仰视
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
④已知测的下列数据:
则待测烧碱溶液的物质的量浓度为0.08mol/L.
①滴定终点时的现象为锥形瓶中的溶液由红色变无色且在半分钟内不恢复;
②滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化;
③下列操作可能使测定结果偏低的是C.
A.酸式滴定管在装酸液前未用标准酸液润洗
B.开始时酸式滴定管尖嘴部分留有气泡,滴定过程中消失
C.装待测液的滴定管,放液前平视,后仰视
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
④已知测的下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
5. 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{15.95+15.00+15.05+14.95}{4}$mL=15.24mL.指出他的计算的不合理之处第一次误差明显大,属异常值,应舍去.按正确数据处理,可得c(市售白醋)=0.45mol•L-1;市售白醋总酸量=0.075g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{15.95+15.00+15.05+14.95}{4}$mL=15.24mL.指出他的计算的不合理之处第一次误差明显大,属异常值,应舍去.按正确数据处理,可得c(市售白醋)=0.45mol•L-1;市售白醋总酸量=0.075g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
2. 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是酸式滴定管.选用指示剂是:酚酞
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为:
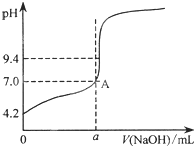
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$20.20mL,他的计算合理吗?理由是不合理;第3组数据和其他三组相差较大,不应采用
通过仪器测得第4次滴定过程中溶液pH随加入氢 氧化钠溶液体积的变化曲线如图所示,则a<20.02(填“>”、“<”或“=”)
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”、“偏小”或“无影响”)
 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是酸式滴定管.选用指示剂是:酚酞
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$20.20mL,他的计算合理吗?理由是不合理;第3组数据和其他三组相差较大,不应采用
通过仪器测得第4次滴定过程中溶液pH随加入氢 氧化钠溶液体积的变化曲线如图所示,则a<20.02(填“>”、“<”或“=”)
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”、“偏小”或“无影响”)
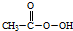 (过氧乙酸)+H2O
(过氧乙酸)+H2O