题目内容
5. 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{15.95+15.00+15.05+14.95}{4}$mL=15.24mL.指出他的计算的不合理之处第一次误差明显大,属异常值,应舍去.按正确数据处理,可得c(市售白醋)=0.45mol•L-1;市售白醋总酸量=0.075g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
分析 Ⅰ.(1)根据量取液体体积的精确度以及液体的性质选择仪器;溶液的定容在对应体积的容量瓶中进行;
(2)醋酸与氢氧化钠溶液恰好反应时生成醋酸钠,溶液呈碱性,可用酚酞作指示剂;
(3)根据滴定管的结构与精确度来分析;
(4)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH 溶液反应的关系式:CH3COOOH~NaOH来解答;
(2)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:I.(1)滴定管精确度为0.01ml,醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋;用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液;
故答案为:酸式滴定管;容量瓶;
(2)由于醋酸钠溶液显示碱性,可用酚酞作指示剂,则用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞,
故答案为:酚酞;
(3)滴定管液面的读数0.60mL;
故答案为:0.60;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去,3次消耗NaOH溶液的体积为:15.00mL、15.05mL、14.95mL,则NaOH溶液的平均体积为15.00mL;
设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 0.1000mol/L×0.015L×40g/mol
x=0.450;
c(市售白醋)=$\frac{0.450g}{\frac{60g/mol}{0.01L}}$=0.75mol•L-1,样品总酸量$\frac{0.75×60}{10}$=4.50g•100mL-1;
故答案为:第一次误差明显大,属异常值,应舍去; 0.075; 0.45;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,溶液浓度偏高,故a选;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,溶液浓度偏高,故b选;
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,溶液浓度不变,故c不选;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,溶液浓度偏低,故d不选;
故选:ab.
点评 本题考查了酸碱中和滴定,题目难度不大,注意把握中和滴定的原理、基本操作和误差分析的方法.

 阅读快车系列答案
阅读快车系列答案| A. | 8 | B. | 10 | C. | 18 | D. | 26 |
| A. | 所有△H<0的反应均是自发反应 | |
| B. | 高锰酸钾加热分解是一个熵减小的过程 | |
| C. | 冰在室温下自动熔化成水,是熵增的过程 | |
| D. | 自发进行的反应一定能迅速进行 |
| A. | 滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| B. | 锥形瓶沾有少量水 | |
| C. | 以甲基橙作指示剂 | |
| D. | 滴定前仰视滴定管读数,滴定后平视刻度读数 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(杂质不与I-发生氧化还原反应)的纯度,过程如下:取试样溶于水,加入过量KI固体,充分反应,有白色沉淀(CuI)产生.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL.(已知:I2+2S2O32-═S4O62-+2I-.)
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
②可选用淀粉作滴定指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3,淀粉由蓝色变成无色且半分钟不变化.
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
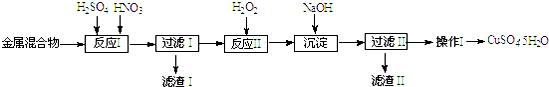
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是使Fe2+氧化为Fe3+.
(3)生成沉淀反应的离子方程式有Fe3++3OHˉ=Fe(OH)3↓.
(4)操作Ⅰ的步骤是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2++4Iˉ=2CuI↓+I2
C. 继续向上述混合物中,逐滴加入0.1000mol•L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O32-=2Iˉ+S4O62-,则样品中胆矾晶体的质量分数96%.
| A. | 左、下方区域 | B. | 左、上方区域 | C. | 右、上方区域 | D. | 右、下方区域 |
 对叔丁基苯酚(
对叔丁基苯酚(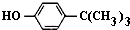 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.