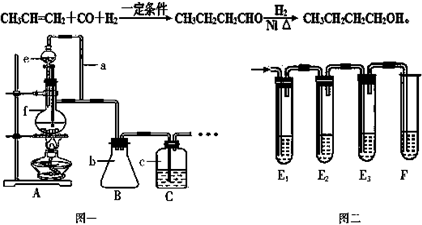
题目内容
19.下列元素的原子半径依次增大的是( )| A. | Na Mg Al | B. | Na O F | C. | P Si Al | D. | C Si P |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越多原子半径越大.
解答 解:A.Na、Mg、Al同周期,自左而右原子半径减小,故原子半径:Na>Mg>Al,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>O>F,故B错误;
C.P、Si、Al同周期,随原子序数增大原子半径减小,故原子半径:P<Si<Al,故C正确;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越多原子半径越大,故原子半径:C<P<Si,故D错误.
故选:C.
点评 本题考查微粒半径半径,比较基础,注意理解同周期、同主族原子半径变化规律,识记Cl原子半径在第二周期主族元素原子半径所处位置、Li原子半径在第三周期主族元素中原子半径位置.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
9. 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
填空:(1)以上步骤有错误的是①(填编号),该错误操作会导致测定结果偏大.(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果偏小.(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:无色变为粉红,半分钟内不变色;
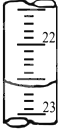
(4)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol•L-1
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
填空:(1)以上步骤有错误的是①(填编号),该错误操作会导致测定结果偏大.(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果偏小.(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:无色变为粉红,半分钟内不变色;
(4)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol•L-1
| 滴定次数 | 待测液 体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
10.已知X、Y、Z三种醇互为同系物,则建立在假设基础上的推断正确的是( )
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 | |
| D. | 由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
14.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:答下列有关问题:
(1)预测周期表中电负性最大的元素应为F;估计钙元素的电负性的取值范围:0.8<X<1.2
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
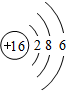 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.