题目内容
5.碘与氢气一定条件下反应的热化学方程式如下(Ⅰ) I2(g)+H2(g)═2HI(g)△H=-9.48KJ/mol
(Ⅱ) I2(s)+H2(g)═2HI(g)△H=+26.48KJ/mol
下列判断正确的是( )
| A. | 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高 | |
| B. | 反应(Ⅰ)和反应(Ⅱ)均为放热反应 | |
| C. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| D. | 1mol H2(g)通入1mol I2中在该条件下反应的反应放热为9.48 kJ |
分析 A、氢气与碘的反应为可逆反应,反应不能完全进行;
B、根据盖斯定律结合方程式求出,固态碘转化为气态碘的热效应;
C、同一物质稳定性相同;
D、产物相同,放出的热量越多,则反应物具有的能量越高.
解答 解:A、产物相同,放出的热量越多,则反应物具有的能量越高,反应(Ⅰ)的产物与反应(Ⅱ)的产物为同一物质,反应(I)放热,反应(II)吸热,所以反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高,故A正确;
B、已知(Ⅰ) I2(g)+H2(g)?2HI(g)△H=-9.48KJ/mol
(Ⅱ) I2(s)+H2(g)?2HI(g)△H=+26.48KJ/mol;反应Ⅱ为吸热反应,故B错误;
C、反应(Ⅰ)的产物与反应(Ⅱ)的产物为同一物质,具有的能量相同,则稳定性相同,故C错误;
D、氢气与碘的反应为可逆反应,反应不能完全进行,所以2 g H2(g)通入254 g I2(g)中不能全部转化为碘化氢,则放出的热量小于9.48 kJ,故D错误.
故选:A.
点评 本题考查了可逆反应的特点,盖斯定律的应用,物质稳定性的判断,物质具有的能量高低的比较;属于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
16.同温同压下,等体积的两个密闭容器中分别充满12C18O和14N2两种气体,下列说法正确的是( )
| A. | 分子数和质量分别不等 | B. | 质子数相等,质量不等 | ||
| C. | 分子数和质量都相等 | D. | 原子数、中子数和质子数都相等 |
13.某有机物结构简式为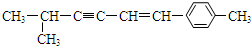 ,关于该有机物的空间构型下列说法中正确的是( )
,关于该有机物的空间构型下列说法中正确的是( )
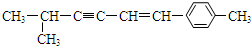 ,关于该有机物的空间构型下列说法中正确的是( )
,关于该有机物的空间构型下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为16个 |
20.下列反应中属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. | 2CH3CH2OH+2Na→2 CH3CH2ONa+H2↑ | |
| D. |  |
10.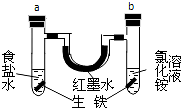 如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )
如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )
 如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )
如图装置中,U型管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液(已知氯化铵溶液呈酸性),各加入生铁块,放置一段时间.下列有关描述错误的是( )| A. | a中发生了吸氧腐蚀,b中发生了析氢腐蚀 | |
| B. | a中正极反应方程式是:O2+2H2O+4e-═4OH- | |
| C. | a、b试管中生铁块中铁都作电池的负极 | |
| D. | 红墨水在一段时间后,两边液面变为左低右高 |
17.关于下列图示的说法中,正确的是( )
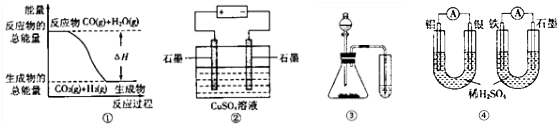

| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0 | |
| B. | 图②为电解硫酸铜溶液的装置,一段时间后,阴、阳两极有可能收集到相同体积的气体 | |
| C. | 图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的试验 | |
| D. | 图④两个装置中个,通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
19.反应CH2=CH2+H2→CH3-CH3,有关化学键的键能如下:
则该反应的反应热△H为( )
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol-1) | 414.4 | 615.3 | 347.4 | 435.5 |
| A. | +288.8kJ/mo1 | B. | -703.4 kJ/mo1 | C. | +125.4kJ/mo1 | D. | -125.4 kJ/mo1 |

 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1