题目内容
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
分析 A.离子之间不发生任何反应;
B.使甲基橙变红的溶液呈酸性;
C.有颜色的离子不能大量存在;
D.由水电离出的c(H+)=10-12 mol•L-1的溶液可能呈酸性或碱性.
解答 解:A.BaCl2溶液中离子之间不发生任何反应,可大量共存,故A正确;
B.使甲基橙变红的溶液呈酸性,酸性条件下CH3COO-不能大量共存,故B错误;
C.Fe2+有颜色,不符合题目无色要求,故C错误;
D.由水电离出的c(H+)=10-12 mol•L-1的溶液,水的电离受到抑制,永夜可能呈酸性或碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,侧重考查复分解反应、氧化还原反应,为高考高频点,明确离子共存条件及离子性质即可解答,易错选项是D,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
9.有两种金属的合金13 g,与足量稀硫酸反应后,在标准状况下产生气体11.2 L,则组成该合金的金属不可能是( )
| A. | Mg和Al | B. | Mg和Zn | C. | Al和Zn | D. | Al和Fe |
7.某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,则该卤代烷的结构有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
15.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )
| A. | 光电池 | B. | 光导纤维 | C. | 石英钟表 | D. | 陶瓷餐具 |
19.为了说明盐类水解是吸热反应,常温下,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
20.化学与人类生产、生活密切相关,下列有关说法错误的是( )
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.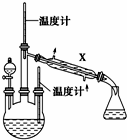 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl