��Ŀ����
7��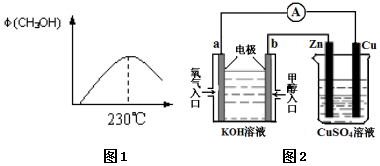 ��Դ����������������ٵ��ش���⣬�״���δ����Ҫ����Դ����֮һ��
��Դ����������������ٵ��ش���⣬�״���δ����Ҫ����Դ����֮һ����1���ϳɼ״��ķ�ӦΪ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾij�κϳ�ʵ������м״�����������գ�CH3OH���뷴Ӧ�¶ȵĹ�ϵ���ߣ���÷�Ӧ�ġ�H��0�������������=����ͬ��
��2������230��ʱ��ƽ�ⳣ��K=1���������������䣬���¶����ߵ�500��ʱ���ﵽƽ��ʱ��K��1��
��3����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2���ﵽƽ��ʱCO��ת����Ϊ90%����ʱ�����ڵ�ѹǿΪ��ʼʱ��0.55����
��4�����ü״�ȼ�ϵ�������ͼ2��ʾ��װ�ã�
�����װ����bΪ�������õ缫�����ĵ缫����ʽΪ��CH3OH+8OH--6e-=CO32-+6H2O����Ӧ����һ��ʱ���ԭ�����ҺPH��С��������С�䣩д��װ���е����ڷ�����Ӧ�����ӷ�ʽZn+Cu2+=Zn2++Cu��
�ڵ�ͭƬ�������仯Ϊ12.8gʱ�����·ת�Ƶĵ�����ĿΪ0.4mol��a�������ĵ�O2�ڱ�״���µ����Ϊ2.24L�� ��Ӧ��ɺ�������Һ�����ʵ�����������С��������С�䣩
��5����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ������һ�ּ����ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H=+1411.0kJ/mol
2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H=+1366.8kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽC2H4��g��+H2O��l���TC2H5OH����H=-44.2kJ/mol��
�ڹ�ҵ�����У���θ�����ϩˮ�����Ҵ�����ʽ�������ϩ�������ʣ�ת���ʣ�1�����¶ȣ�2���ϵ������Ҵ�����д������
���� ��1��230�洦��ƽ��״̬���������¶ȼ״������������˵�������¶�ƽ�����淴Ӧ�����ƶ���
��2��˵�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��
��3���μӷ�ӦCOΪ2.5mol��90%=2.25mol����������ƽ��ʱ������������ʵ��������º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ�
��4���ټ״�ȼ�ϵ�أ�ȼ���ڸ�������������Ӧ��bΪ������b�缫�ϼ״�ʧȥ���ӣ���������������̼���������ˮ���ɵ缫����ʽ�ж�PH�仯��
�ڸ��ݵ���ת���غ������������������������ܷ�Ӧ����ʽ�жϣ�
��5�����ݸ�˹���������㷴Ӧ���ʱ䲢��д�Ȼ�ѧ����ʽ���¶ȣ�Ũ�ȵȶ����ʵ�ת������Ӱ�죮
��� �⣺��1��230�洦��ƽ��״̬���������¶ȼ״������������˵�������¶�ƽ�����淴Ӧ�����ƶ����������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ�����H��0���ʴ�Ϊ������
��2������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С����K��1���ʴ�Ϊ������
��3���μӷ�ӦCOΪ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� �������ʵ�����С
1 2
2.25mol 4.5mol
��ƽ��������������ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ���ʱ�����ڵ�ѹǿΪ��ʼʱ��$\frac{5.5mol}{2.5mol+7.5mol}$=0.55����
�ʴ�Ϊ��0.55��
��4���ټ״�ȼ�ϵ�أ�ȼ���ڸ�������������Ӧ����bΪ������b�缫�ϼ״�ʧȥ���ӣ���������������̼���������ˮ���缫��ӦʽΪ��CH3OH+8OH--6e-=CO32-+
6H2O���ɵ缫��Ӧ����ʽ֪OH-���ϼ�С����PH��С�������ڷ�����Ӧ�����ӷ�ʽΪ��Zn+Cu2+=Zn2++Cu��
�ʴ�Ϊ������CH3OH+8OH--6e-=CO32-+6H2O����С��Zn+Cu2+=Zn2++Cu��
�ڵ�ͭƬ�������仯Ϊ12.8gʱ�����ĵ�n��Cu��=$\frac{12.8}{64}$=0.2mol����Cu��Cu2+ת�Ƶĵ�����Ϊ2mol����n��e-��=0.4mol�����ݵ���ת���غ��֪��������Ϊ$\frac{0.2mol��2}{4}$=0.1mol����a�������ĵ�O2�ڱ�״���µ����Ϊ0.1mol��22.4L/mol=2.24L��Zn+CuSO4=Cu+ZnSO4��CuSO4���ϵ����ĵ�����������������С��
�ʴ�Ϊ��0.4mol��2.24����С��
��5����2CO2��g��+2H2O��l���TC2H4��g��+3O2��g����H1=+1411.0kJ/mol
��2CO2��g��+3H2O��l���TC2H5OH��1��+3O2��g����H2=+1366.8kJ/mol
���ݸ�˹���ɷ�ӦC2H4��g��+H2O��l���TC2H5OH��l�����ڢ�-�٣����ԡ�H=��H2-��H1=-44.2 kJ/mol����ΪC2H4��g��+H2O��l���TC2H5OH����H=-44.2 kJ/mol��
�����¶�����ȷ�����У��ʽ����¶ȿ������ϩת���ʣ����ϵ������������Ӧ��Ũ�����ӣ��ʷ�Ӧ������Ӧ�������Ҳ�������ϩת���ʣ�
�ʴ�Ϊ��C2H4��g��+H2O��l���TC2H5OH����H=-44.2kJ/mol�������¶ȣ����ϵ������Ҵ���
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ����ԭ�������ԭ���ȣ��Ѷ��еȣ�

 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�| A�� | 672 mL | B�� | 168 mL | C�� | 504 mL | D�� | 224 mL |
| A�� | ������ȫ���ܽ�ʱ���μӷ�Ӧ����������ʵ���һ����0.4 mol | |
| B�� | �μӷ�Ӧ�Ľ����������� 3.6 g��m��9.6 g | |
| C�� | �����ɵij������ﵽ���ʱ������NaOH��Һ�����V=200 mL | |
| D�� | ������ȫ���ܽ�ʱ�ռ���NO���������ڱ����Ϊ 2.24 L |
��1������һ�������ȼҵ��Ʒ����SO2���������������£�
�١�����װ�á��з�����Ӧ�����ӷ���ʽSO2+OH-=HSO3-��
�ںϳ�����ÿ�ϳ�1mol����ų�����92.3kJ��25�桢101kPa������Ӧ���Ȼ�ѧ����ʽH2��g��+Cl2��g��=2HCl��g����H=-184.6 kJ•mol-1��
������������ѭ�����õ�������NaCl��Һ��
��2��������������FeCl3��Һ��������������SO2
�ٸ÷�Ӧ�����ӷ���ʽ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+����Ӧa����Ϊ��֤�÷�Ӧ��ͬѧ�ǽ�SO2ͨ��0.05mol/LFeCl3��Һ�У���Һ�ܿ��ɻ�ɫ��Ϊ���ɫ������Һ��ʱ����ú����ձ�Ϊdz��ɫ�����ں��ɫҺ�壬������ͬѧ�ǵķ����Ʋ���ʵ�飮
| �����Ʋ� | ʵ�鲽�輰���� |
| �ף�������Fe��OH��3���� �ң����������ϣ����ܷ�����Ӧ�� Fe3++6SO2?Fe��SO2��63+����Ӧb�� | I���Ʊ�Fe��OH��3���岢���� II���ֱ���Fe��OH��3����ú��ɫҺ���м����������ۣ���ǰ�߲���ɫ�����߱�Ϊdz��ɫ |
�۸��ݷ�Ӧb˵������II��Һ����ɫ�仯��ԭ���Ǽ�������ʱ������Ӧ2Fe3++Fe=3Fe2+��c��Fe3+����С��ʹ��Ӧb�����ƶ��������ӷ���ʽ����Ҫ������˵������
| A�� | ú�Ϳ���ʯ�ͷ����ã�������ȼ�Ϻͱ������������� | |
| B�� | ʯ���ǻ���������Ʒ����Ϊ������ | |
| C�� | ú������Ҫ�õ���̿��ú���͡��ְ�ˮ�ͽ�¯�� | |
| D�� | ʯ�ͷ���ɻ�����ᡢ������������ |
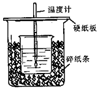 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ Ϊ̽���ⶨ�к��ȵ�ʵ�飬С������50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȣ��к�����ֵΪ57.3kJ/mol����
Ϊ̽���ⶨ�к��ȵ�ʵ�飬С������50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȣ��к�����ֵΪ57.3kJ/mol����