题目内容
如图是电解CuCl2溶液的装置,其中a、b为石墨电极,则下列判断中,正确的是( )

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:直流电源中,电流从正极流出,从负极流入;电解池中,连接原电池负极的电极是电解池的阴极,连接原电池正极的电极是电解池阳极,电解氯化铜溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,据此分析解答.
解答:
解:A、直流电源中,电流从正极流出,从负极流入,a接电源正极是阳极,故A错误;
B、电解氯化铜溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,溶液浓度减小,故B错误;
C、电解过程中,b电极是阴极,该电极上铜离子得电子析出金属铜,电极质量增加,故C错误;
D、电解氯化铜溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,每转移2mol电子生成铜和氯气各1mol,故D正确;
故选D.
B、电解氯化铜溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,溶液浓度减小,故B错误;
C、电解过程中,b电极是阴极,该电极上铜离子得电子析出金属铜,电极质量增加,故C错误;
D、电解氯化铜溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,每转移2mol电子生成铜和氯气各1mol,故D正确;
故选D.
点评:本题考查了原电池和电解池原理,先根据电流方向判断原电池正负极,再根据电解原理来分析解答即可,难度不大.

练习册系列答案
相关题目
将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后溶液中离子浓度的关系正确( )
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量.②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量.③由H原子和Cl原子形成1mol HCl分子时要放出431kJ的能量.下列叙述正确的是( )
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)═2HCl(g) |
| B、氢气与氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 |
| C、氢气与氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
| D、氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 |
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,又知电解质的电离是吸热过程.向1L 0.5mol?L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应.其焓变△H1、△H2、△H3的关系是( )
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H1=△H3>△H2 |
| D、△H1>△H3>△H2 |
下列关于反应热的表述正确的是( )
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
已知氧化性从强到弱的顺序是:Cl2>Br2>Fe2+>I2,则下列化学方程式(或离子方程式)中错误的是( )
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |
下列离子方程式表达正确的是( )
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
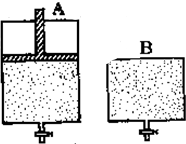 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).