题目内容
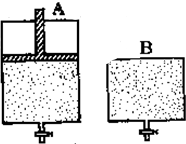 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).在保持400℃的条件下使之发生如下反应:2SO2+O2?2SO3.试填写下列空格:
(1)A容器达到平衡时所需的时间比B容器
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学平衡
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数
考点:化学平衡的影响因素
专题:
分析:(1)根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
(2)根据容器中的压强对化学平衡的影响;
(3)根据浓度对化学平衡的影响,求出平衡移动后SO3的体积分数.
(2)根据容器中的压强对化学平衡的影响;
(3)根据浓度对化学平衡的影响,求出平衡移动后SO3的体积分数.
解答:
解:(1)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B短,若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,故答案为:短;大;
(2)平衡后,若向两容器通入数量不多的等量氩气,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向逆反应方向移动,A容器体积不变,压强增大,参加反应的气体产生的压强不变,平衡不移动,故答案为:向逆反应方向;不移动;
(3)向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,故答案为:不变;增大.
(2)平衡后,若向两容器通入数量不多的等量氩气,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向逆反应方向移动,A容器体积不变,压强增大,参加反应的气体产生的压强不变,平衡不移动,故答案为:向逆反应方向;不移动;
(3)向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,故答案为:不变;增大.
点评:本题考查化学平衡移动的判断,本题难度较大,注意等效平衡的理解和应用.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下列叙述中,正确的是( )
| A、有单质参加的化合反应都是氧化还原反应 |
| B、在氧化还原反应中,还原剂有还原性,发生还原反应生成还原产物 |
| C、在氧化还原反应中,元素由化合态变为游离态,此元素可能被还原也可能被氧化 |
| D、失电子多的还原剂的还原性强 |
下列各组物质性质比较中,正确的是( )
| A、氢化物沸点:HI>HBr>HCl>HF |
| B、分子稳定性:HF>HCl>HBr>HI |
| C、离子半径:K+>Cl->S2- |
| D、单质熔点:Li<Na<K<Rb |
一个原电池的总反应为Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
| A、正极 Zn 负极 Cu 电解质溶液 CuCl2 |
| B、正极Cu 负极Zn 电解质溶液 CuCl2 |
| C、正极Zn 负极Cu 电解质溶液 ZnCl2 |
| D、正极Cu 负极Zn 电解质溶液 ZnCl2 |
如图是电解CuCl2溶液的装置,其中a、b为石墨电极,则下列判断中,正确的是( )

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |
下列物质中,只含有极性共价键的是( )
| A、CaCl2 |
| B、KOH |
| C、H2 |
| D、H2O |