题目内容
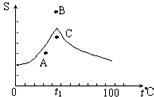 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |
考点:溶解度、饱和溶液的概念
专题:电离平衡与溶液的pH专题
分析:A、A在该温度的溶解度曲线以下,代表a溶液不饱和,降温可以降低溶解度,加入溶质也可使不饱和溶液变为饱和溶液;
B、固体物质的溶解度受到溶质和溶剂、温度的影响,溶质和溶解确定时时,温度一定,该溶质的溶解度为一定值;
C、从C点所在的温度升温或降温溶解度都降低,因此升温或降温均可以成为过饱和溶液;
D、Na2SO4在示t1℃时溶解度最大,应该尽量在溶解度最大的温度配制饱和溶液.
B、固体物质的溶解度受到溶质和溶剂、温度的影响,溶质和溶解确定时时,温度一定,该溶质的溶解度为一定值;
C、从C点所在的温度升温或降温溶解度都降低,因此升温或降温均可以成为过饱和溶液;
D、Na2SO4在示t1℃时溶解度最大,应该尽量在溶解度最大的温度配制饱和溶液.
解答:
解:A、A在该温度的溶解度曲线以下,代表a溶液不饱和,降温可以降低溶解度,加入溶质也可使不饱和溶液变为饱和溶液,故A正确;
B、B、C点在t1℃时,Na2SO4的溶解度相等,为一定值,故B错误;
C、从C点所在的温度升温或降温溶解度都降低,因此升温或降温均可以成为过饱和溶液,故C正确;
D、Na2SO4在示t1℃时溶解度最大,应该尽量在溶解度最大的温度配制饱和溶液,故D错误;
故选:BD.
B、B、C点在t1℃时,Na2SO4的溶解度相等,为一定值,故B错误;
C、从C点所在的温度升温或降温溶解度都降低,因此升温或降温均可以成为过饱和溶液,故C正确;
D、Na2SO4在示t1℃时溶解度最大,应该尽量在溶解度最大的温度配制饱和溶液,故D错误;
故选:BD.
点评:本题考查溶解度和饱和溶液的概念,侧重于对溶解度的理解,注意固体物质的溶解度受到溶质和溶剂、温度的影响,三者均确定不变后,溶质的溶解度就是一个定值.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
以下实验操作不能达到相应的实验目的是( )
A、 闻气体的气味 |
B、 用浓硫酸干燥氢气 |
C、 向容量瓶中转移液体 |
D、 检验钾元素的存在 |
短周期元素U、V、W、X的原子序数依次增大,其简单离子能促进水的电离平衡的是( )
| A、U-、V+ |
| B、V+、W2+ |
| C、W2+、X- |
| D、U-、W2+ |
某无色溶液中能大量共存的一组离子是( )
| A、NH4+、H+、I-、CrO42- |
| B、Pb2+、Na+、Cl-、SO42- |
| C、Na+、Mg2+、Cl-、SO42- |
| D、Na+、Al3+、Br-、CO32- |
向200毫升0.10mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,过滤、洗涤,将所得的沉淀灼烧至质量不再变化,其质量为( )
| A、1.44克 |
| B、1.60克 |
| C、4.36克 |
| D、4.84克 |
某学小组同学设计了以下三组实验验证某无色溶液中含有的离子.下列说法正确的是( )
(1)溶液
直接观察无明显的紫色火焰:证明没有K+
(2)溶液
产生白色沉淀:证明有SO42-
(3)溶液
白色沉淀
无色溶液
白色沉淀:证明有Al3+.
(1)溶液
| 用Pt丝灼烧 |
| ① |
(2)溶液
| +氯化钡溶液 |
| ② |
| +稀HCl酸化 |
| ③ |
(3)溶液
| +稀氨水 |
| ④ |
| +烧碱溶液 |
| ⑤ |
| 通入过量CO2 |
| ⑥ |
| A、该无色溶液不可能是明矾溶液 |
| B、这三组实验中,只有(3)是严密合理的 |
| C、步骤④的离子方程式为:Al3++3OH-=Al(OH)3↓ |
| D、步骤⑥的化学方程式为:NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3 |