题目内容
某水(含H2O与D2O)0.2mol的质量为3.64g,试计算:
(1)该水的平均相对分子质量为多少?
(2)该水中普通氢(H)与重(D)的物质的量之比为多少?
(3)在3.64g该水中,含普通水(H2O)的质量为多少?
(1)该水的平均相对分子质量为多少?
(2)该水中普通氢(H)与重(D)的物质的量之比为多少?
(3)在3.64g该水中,含普通水(H2O)的质量为多少?
考点:物质的量的相关计算
专题:计算题
分析:(1)结合
=
计算;
(2)根据质量和物质的量关系,计算出H2O与D2O的物质的量之比,可得水中普通氢(H)与重(D)的物质的量之比;
(3)计算出H2O与D2O的物质的量,可计算普通水(H2O)的质量.
. |
| M |
| m |
| n |
(2)根据质量和物质的量关系,计算出H2O与D2O的物质的量之比,可得水中普通氢(H)与重(D)的物质的量之比;
(3)计算出H2O与D2O的物质的量,可计算普通水(H2O)的质量.
解答:
解:设H2O为xmol,D2O为ymol,则
,解得x=0.18,y=0.02,
(1)
=
=
=18.2mol/L,答:水的平均相对分子质量为18.2;
(2)水中普通氢(H)与重(D)的物质的量之比为:2×0.18mol:2×0.02mol=9:1,
答:水中普通氢(H)与重(D)的物质的量之比为9:1;
(3)m(H2O)=0.18mol×18g/mol=3.24g,答:在3.64g该水中,含普通水(H2O)的质量为3.24g.
|
(1)
. |
| M |
| m |
| n |
| 3.64g |
| 0.2mol |
(2)水中普通氢(H)与重(D)的物质的量之比为:2×0.18mol:2×0.02mol=9:1,
答:水中普通氢(H)与重(D)的物质的量之比为9:1;
(3)m(H2O)=0.18mol×18g/mol=3.24g,答:在3.64g该水中,含普通水(H2O)的质量为3.24g.
点评:本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,把握物质的构成特点,难度不大.

练习册系列答案
相关题目
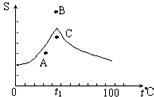 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |
对于1.204×1024个H2,下列说法不正确的是( )
| A、它可与1mol O2完全反应(点燃) |
| B、它是4mol H |
| C、它是与16g CH4所含的H的数目相同 |
| D、它与2NA个H2SO4所含的H的数目相同 |

