题目内容
短周期元素U、V、W、X的原子序数依次增大,其简单离子能促进水的电离平衡的是( )
| A、U-、V+ |
| B、V+、W2+ |
| C、W2+、X- |
| D、U-、W2+ |
考点:位置结构性质的相互关系应用,水的电离
专题:元素周期律与元素周期表专题
分析:根据答案选项可知,短周期元素U、V、W、X的原子序数依次增大,形成的简单离子分别为U-、V+、W2+、X-,V处于ⅠA族,W处于ⅡA族,U、X处于ⅦA族,结合原子序数,可推出U为F元素、V为Na元素、W为Mg元素、Z为Cl元素,它们的简单离子中都能破坏水的电离,说明该离子为弱离子,能发生水解反应.
解答:
解:根据答案选项可知,短周期元素U、V、W、X的原子序数依次增大,形成的简单离子分别为U-、V+、W2+、X-,V处于ⅠA族,W处于ⅡA族,U、X处于ⅦA族,结合原子序数,可推出U为F元素、V为Na元素、W为Mg元素、Z为Cl元素,它们的简单离子中都能破坏水的电离,说明该离子为弱离子,能发生水解反应,
U-为F-离子,为弱酸根离子,能发生水解而影响水的电离;
W2+为Mg2+离子,为弱离子,能发生水解反应而影响水的电离;
X-为Cl-离子,不发生水解,不能影响水的电离;
V+为Na+为钠离子,不发生水解,所以不影响水的电离,
故选D.
U-为F-离子,为弱酸根离子,能发生水解而影响水的电离;
W2+为Mg2+离子,为弱离子,能发生水解反应而影响水的电离;
X-为Cl-离子,不发生水解,不能影响水的电离;
V+为Na+为钠离子,不发生水解,所以不影响水的电离,
故选D.
点评:本题考查了元素的判断、离子的水解等知识点,注意根据选项中形成的离子再结合题给信息确定元素,难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列各组离子,可以大量共存的是( )
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、Ag+、Na+、NO3-、Br- |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01 | ||
B、室温时,若在NaZ溶液中加水,则
| ||
| C、等物质的量的 NaX、NaY和NaZ的三种溶液,其pH:NaX<NaY<NaZ | ||
| D、在相同温度下,K5>K4>K3 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、室温下:Fe2+、H+、Cl-、NO3- |
| B、含有大量Fe3+的溶液中:SCN-、K+、Mg2+、I- |
| C、澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42- |
| D、室温下:Na+、Mg2+、NO3-、SO42- |
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体.已知反应:甲+乙→丁+己,甲+丙→戊+己;常温下0.01mol?L-1丁溶液的pH为12.下列说法正确的是( )
| A、元素X在周期表中的位置为第2周期VIA族 |
| B、元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C、1mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D、1.0L 0.1mol?L-1戊溶液中阴离子的总物质的量小于0.1mol |
物质分类是化学研究的重要方法之一.近年来发现,在金星大气层中存在三氧化二碳.下列物质与它属于同类的是( )
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
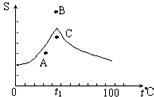 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |