题目内容
现有H2SO4和Na2SO4溶液200mL,其中H2SO4的浓度是1mol/L,Na2SO4的浓度是0.5mol/L,要使H2SO4和Na2SO4的浓度分别为2mol/L和0.2mol/L,求应加入55.8%的H2SO4(密度为1.35g/cm3)溶液的体积和配制的溶液的体积.
考点:物质的量浓度的相关计算
专题:计算题
分析:硫酸钠的物质的量不变,根据稀释定律,计算混合后溶液的体积;
根据混合后硫酸的浓度,根据n=cV计算混合后n(H2SO4),进而计算加入的硫酸的物质的量,根据c=
计算55.8%的H2SO4溶液的物质的量浓度,再根据V=
计算需要加入的55.8%的H2SO4溶液的体积.
根据混合后硫酸的浓度,根据n=cV计算混合后n(H2SO4),进而计算加入的硫酸的物质的量,根据c=
| 1000ρw |
| M |
| n |
| c |
解答:
解:硫酸钠的物质的量不变,根据稀释定律,令混合后溶液的体积为V,则:
200mL×0.5mol?L-1=V×0.2mol?L-1,解得V=500mL,选用500mol容量瓶配制500ml溶液;
故混合后溶液中n(H2SO4)=0.5L×2mol?L-1=1mol,
故加入的硫酸的物质的量为:1mol-0.2L×1mol?L-1=0.8mol,
55.8%的H2SO4溶液的物质的量浓度c=
mol/L=7.69mol/L,故需要加入55.8%的H2SO4溶液的体积为=
=104mL,
答:需要加入的55.8%的H2SO4溶液的体积为104mL,配制的溶液的体积为500ml.
200mL×0.5mol?L-1=V×0.2mol?L-1,解得V=500mL,选用500mol容量瓶配制500ml溶液;
故混合后溶液中n(H2SO4)=0.5L×2mol?L-1=1mol,
故加入的硫酸的物质的量为:1mol-0.2L×1mol?L-1=0.8mol,
55.8%的H2SO4溶液的物质的量浓度c=
| 1000×1.35×55.8% |
| 98 |
| 0.8mol |
| 7.69mol/L |
答:需要加入的55.8%的H2SO4溶液的体积为104mL,配制的溶液的体积为500ml.
点评:本题考查物质的量浓度的有关计算,难度中等,根据硫酸钠的物质的量不变计算混合后溶液的体积是关键.

练习册系列答案
相关题目
下列各组离子,可以大量共存的是( )
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、Ag+、Na+、NO3-、Br- |
物质分类是化学研究的重要方法之一.近年来发现,在金星大气层中存在三氧化二碳.下列物质与它属于同类的是( )
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
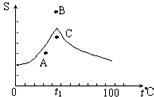 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
下列说法不正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4(g)的反应为放热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L |
| D、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) |
