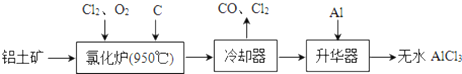
题目内容
2.等质量的 SO2 和 SO3 相比较,下列结论正确的是( )| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
分析 根据质量计算气体的物质的量,可得物质的量之比,根据分子组成可得原子数之比,同温同压下,气体的物质的量之比等于体积之比,密度之比等于相对分子质量之比.
解答 解:A、由n=$\frac{m}{M}$,N=nNA,设气体的质量为m,可知所含硫原子数目之比是$\frac{m}{64}$×1:$\frac{m}{80}$×1=5:4,故A正确;
B、所含O原子数目之比是$\frac{m}{64}$×2:$\frac{m}{80}$×3=5:6,故B错误;
C、所含O原子数目之比是$\frac{m}{64}$×2:$\frac{m}{80}$×3=5:6,则氧元素的质量之比为 5:6,故C错误;
D、所含硫原子数目之比是$\frac{m}{64}$×1:$\frac{m}{80}$×1=5:4,则硫元素的质量之比为 4:5,故D错误.
故选A.
点评 本题考查阿伏加德罗定律及推论,题目难度中等,注意物质的量与体积、密度、原子数目的计算公式的运用.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
13.某化学实验小组利用图所有仪器连接而成制备氮化镁,并探究其实验
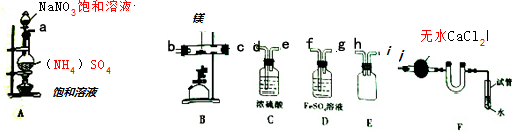
(1)装置A中反应的化学方程式为2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O.
(2)按气流方向的连接顺序是(填入仪器接口字母编号):a→( h )( i )→( f )( g )→( d )( e )→( b ) ( c )→j.
(3)装置E的作用是作安全瓶,防倒吸.
(4)能否将C与D的位置对调并说明理由否,对调后不能除去水蒸气
(5)反应过程中,装置F中的末端导管必须始终插入水中,目的是防止反应过程中空气进入硬质玻璃管
(6)请用化学方法确定是否有氮化镁生成,写出实验操作及现象取少量产物于试管中,加适量蒸馏水溶解,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,证明有氮化镁生成
(7)数据记录如下:
计算得到实验式MgxN2,其中x=2.8
②若没有装置D,请比较x与3的大小,并给出判断依据x<3,若没有装置D,氮气中混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大,故因此$\frac{n(Mg)}{n(O)}$<$\frac{3}{2}$,即x<3.

(1)装置A中反应的化学方程式为2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O.
(2)按气流方向的连接顺序是(填入仪器接口字母编号):a→( h )( i )→( f )( g )→( d )( e )→( b ) ( c )→j.
(3)装置E的作用是作安全瓶,防倒吸.
(4)能否将C与D的位置对调并说明理由否,对调后不能除去水蒸气
(5)反应过程中,装置F中的末端导管必须始终插入水中,目的是防止反应过程中空气进入硬质玻璃管
(6)请用化学方法确定是否有氮化镁生成,写出实验操作及现象取少量产物于试管中,加适量蒸馏水溶解,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,证明有氮化镁生成
(7)数据记录如下:
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
②若没有装置D,请比较x与3的大小,并给出判断依据x<3,若没有装置D,氮气中混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大,故因此$\frac{n(Mg)}{n(O)}$<$\frac{3}{2}$,即x<3.
17.下列物质在熔融状态能导电且属于强电解质的是( )
| A. | 盐酸 | B. | 硫酸 | C. | BaSO4 | D. | NH3•H2O |
7.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
14.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100mL溶液分别进行如下实验:(1)加入AgNO3溶液有沉淀产生;(2)加足量BaCl2溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
11.常温下,关于0.1mol/L的Na2S溶液,下列叙述正确的是( )
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |