题目内容
13.某化学实验小组利用图所有仪器连接而成制备氮化镁,并探究其实验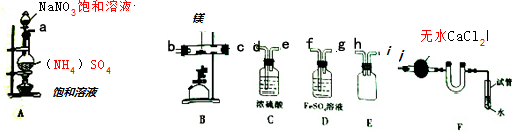
(1)装置A中反应的化学方程式为2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O.
(2)按气流方向的连接顺序是(填入仪器接口字母编号):a→( h )( i )→( f )( g )→( d )( e )→( b ) ( c )→j.
(3)装置E的作用是作安全瓶,防倒吸.
(4)能否将C与D的位置对调并说明理由否,对调后不能除去水蒸气
(5)反应过程中,装置F中的末端导管必须始终插入水中,目的是防止反应过程中空气进入硬质玻璃管
(6)请用化学方法确定是否有氮化镁生成,写出实验操作及现象取少量产物于试管中,加适量蒸馏水溶解,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,证明有氮化镁生成
(7)数据记录如下:
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
②若没有装置D,请比较x与3的大小,并给出判断依据x<3,若没有装置D,氮气中混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大,故因此$\frac{n(Mg)}{n(O)}$<$\frac{3}{2}$,即x<3.
分析 (1)A装置中亚硝酸钠与硫酸铵再加热下制备氮气,反应生成氮气、硫酸钠与水;
(2)A装置制备氮气,B装置中氮气与Mg反应生成氮化镁,反应导致装置内气压减小,需要防止倒吸,硫酸亚铁具有还原性,可以除去氧气、氮的氧化物等氧化性,氮化镁易水解,加入B装置的氮气应干燥,用浓硫酸干燥,加热条件下装置中氧气与Mg反应生成MgO,应下用氮气排尽装置内空气后再制备氮化镁,F防止反应过程中空气进入硬质玻璃管,无水氯化钙吸收水蒸气,防止进入B中;
(3)装置E起安全瓶作用;
(4)对调后不能除去氮气中水蒸气;
(5)装置F中的末端导管必须始终插入水中,可以防止反应过程中空气进入硬质玻璃管;
(6)利用氮化镁水解生成氨气,通过检验氨气判断;
(7)①Mg的质量为142.480g-142.312g=0.168g,产物中N元素质量为142.55g-142.480g=0.07g,再计算Mg、N原子物质的量,结合实验式MgxN2,计算x的值;
②混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大.
解答 解:(1)A装置中亚硝酸钠与硫酸铵再加热下制备氮气,反应生成氮气、硫酸钠与水,反应方程式为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O,
故答案为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(2)A装置制备氮气,B装置中氮气与Mg反应生成氮化镁,反应导致装置内气压减小,需要防止倒吸,硫酸亚铁具有还原性,可以除去氧气、氮的氧化物等氧化性,氮化镁易水解,加入B装置的氮气应干燥,用浓硫酸干燥,加热条件下装置中氧气与Mg反应生成MgO,应下用氮气排尽装置内空气后再制备氮化镁,F防止反应过程中空气进入硬质玻璃管,无水氯化钙吸收水蒸气,防止进入B中,按气流方向的连接顺序是:a→(h)(i)→(f)(g)→(d)(e)→(b)(c)→j[或a→(i)(h)→(f)(g)→(d)(e)→(c)(b)→j],
故答案为:a→(h)(i)→(f)(g)→(d)(e)→(b)(c)→j[或a→(i)(h)→(f)(g)
→(d)(e)→(c)(b)→j];
(3)装置E起安全瓶作用,防止应气压减小导致倒吸,
故答案为:作安全瓶,防倒吸;
(4)对调后不能除去氮气中水蒸气,不能将C与D的位置对调,
故答案为:否,对调后不能除去水蒸气;
(5)反应过程中,装置F中的末端导管必须始终插入水中,可以防止反应过程中空气进入硬质玻璃管,
故答案为:防止反应过程中空气进入硬质玻璃管;
(6)确定是否有氮化镁生成的方法为:取少量产物于试管中,加适量蒸馏水溶解,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,证明有氮化镁生成,
故答案为:取少量产物于试管中,加适量蒸馏水溶解,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,证明有氮化镁生成;
(7)①Mg的质量为142.480g-142.312g=0.168g,其物质的量为$\frac{0.168mol}{24g/mol}$=0.007mol,产物中N元素质量为142.55g-142.480g=0.07g,物质的量为$\frac{0.07g}{14g/mol}$=0.005mol,则n(Mg):n(N)=7:5,实验式为MgxN2,则x=2×$\frac{7}{5}$=2.8,
故答案为:2.8;
②若没有装置D,氮气中混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大,故因此$\frac{n(Mg)}{n(O)}$<$\frac{3}{2}$,即x<3,
故答案为:x<3,若没有装置D,氮气中混有氧气,产物中混有MgO,等质量的Mg分别与O2、N2反应时,生成MgO的质量大于Mg3N2,导致计算样品中N元素质量偏大,故因此$\frac{n(Mg)}{n(O)}$<$\frac{3}{2}$,即x<3.
点评 本题考查物质制备实验,关键是对制备原理与各装置的理解,注意制备中避免水解及杂质生成,题目综合考查学生对知识的迁移运用、分析能力、实验能力等,掌握元素化合物性质与实验制备原则.

| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
| A. | Fe3+ | B. | Al3+ | C. | Na+ | D. | Fe2+ |
| A. | 向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| B. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| C. | 向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明该溶液中有NH4+ | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
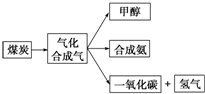 (1)如图是某煤化工产业链的一部分:
(1)如图是某煤化工产业链的一部分:
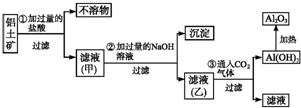 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: