题目内容
11.常温下,关于0.1mol/L的Na2S溶液,下列叙述正确的是( )| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
分析 A.向溶液中加入少量NaOH固体,抑制Na2S的水解;
B.根据质子守恒分析;
C.Na2S溶液存在S2-+H2O?HS-+OH-;
D.从物料守恒的角度分析.
解答 解:A.向溶液中加入少量NaOH固体,增大了钠离子浓度,c(OH-)增大,抑制Na2S的水解,Na2S溶液中的c(Na+)、c(S2-)均增大,故A正确;
B.Na2S溶液中存在着质子守恒,则:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C.Na2S溶液存在S2-+H2O?HS-+OH-,则有c(OH-)>c(H+),所以c(Na+)>c(S2-)>c(OH-)>c(H+),故C错误;
D.物料守恒可知Na的物质的量是S的物质的量的2倍,S在溶液存在形式有3种,所以$\frac{1}{2}$c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误.
故选A.
点评 本题考查离子浓度大小的比较,题目难度不大,注意从物料守恒的角度和质子守恒的角度分析,把握盐类水解的原理,易错点为D,注意离子浓度的关系.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
1.下列叙述中正确的是( )
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
2.等质量的 SO2 和 SO3 相比较,下列结论正确的是( )
| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
19. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到化学平衡的是BC;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
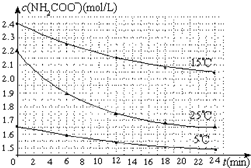
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
6. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)COCl2 的空间构型为平面三角形;溴的基态原子价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生(填字母代号,下同).
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2?
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(或I).
(4)下列分子既不存在“s-p”σ 键,也不存在“p-p”π 键的是D.
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为三角形,中心氯原子周围有四对价层电子.ClO3- 中心氯原子的杂化轨道类型为sp3杂化,写出一个与CN-互为等电子体的物质的分子式N2或CO.
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g/cm3,则晶胞内离得最近的两个钙离子的间距为$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)COCl2 的空间构型为平面三角形;溴的基态原子价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生(填字母代号,下同).
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2?
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(或I).
| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为三角形,中心氯原子周围有四对价层电子.ClO3- 中心氯原子的杂化轨道类型为sp3杂化,写出一个与CN-互为等电子体的物质的分子式N2或CO.
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g/cm3,则晶胞内离得最近的两个钙离子的间距为$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
16.下列关于硫及其化合物的说法中正确的是( )
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫的排放会导致光化学烟雾的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 硫粉在过量的纯氧中燃烧也不能生成三氧化硫 |
20.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).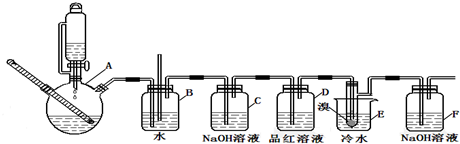
有关数据列表如下:
请完成下列填空:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)请写出C装置中的作用除去乙烯中混有的酸性气体杂质.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行是(填“是”或“否”),其原因是乙烯和液溴均易溶于四氯化碳.
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液.写出由1,2-二溴乙烷制取该有机物的反应方程式:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,反应类型水解反应或取代反应.

有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm2 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)请写出C装置中的作用除去乙烯中混有的酸性气体杂质.
(3)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈.
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行是(填“是”或“否”),其原因是乙烯和液溴均易溶于四氯化碳.
(6)制取的1,2-二溴乙烷可以进一步反应生成一种有机物,汽车常用该有机物作为防冻液.写出由1,2-二溴乙烷制取该有机物的反应方程式:BrCH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,反应类型水解反应或取代反应.
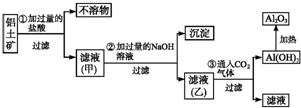 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: