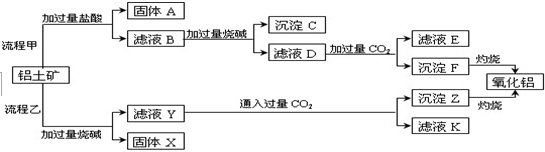
题目内容
8.Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属单质混合物2.40g,用足量的澄清石灰水吸收CO2气体,得5.00g白色沉淀.则a可能为( )| A. | 2.46 g | B. | 3.20 g | C. | 3.59 g | D. | 7.41 g |
分析 发生反应为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,ZnO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,根据反应方程式可知CO2中的O原子来源于CO和金属氧化物,计算出氧化物中氧元素的质量,金属氧化物的质量等于金属的质量加氧化物中氧元素的质量.
解答 解:设生成的二氧化碳的质量为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 5g
x=$\frac{44×5g}{100}$=2.2g,
发生的有关反应为:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,ZnO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,
二氧化碳中碳元素的质量等于一氧化碳中碳元素的质量,故一氧化碳中碳元素质量为:2.2g×$\frac{12}{44}$=0.6g,一氧化碳中氧元素质量为:0.6g×$\frac{16}{12}$=0.8g,二氧化碳中氧元素的质量为:2.2g-0.6g=1.6g,
根据反应方程式可知,CO2中的O原子来源于CO和金属氧化物,则金属氧化物中氧元素的质量为:1.6g-0.8g=0.8g,
所以金属氧化物的质量为:2.40g+0.8g=3.20g,即a=3.20,
故选B.
点评 本题考查混合物的质量计算,题目难度中等,注意从元素质量守恒的角度分析,关键是确定CO2的物质的量等于金属氧化物中氧原子的物质的量,试题培养了学生的化学计算能力.

 阅读快车系列答案
阅读快车系列答案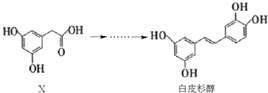
下列说法正确的是( )
| A. | X的分子式为C8H10O4 | |
| B. | 化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体 | |
| C. | 白皮杉醇与浓溴水反应时,最多可消耗6 mol Br2 | |
| D. | 在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应 |
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲醛 | B. | 生石灰 | C. | 过氧化氢 | D. | 次氯酸钠 |
| A. | BaCl2溶液 | B. | Ba(NO3)2溶液 | C. | 浓溴水 | D. | 饱和NaHCO3溶液 |
 对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )
对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )| A. | 电解时Pt电极应与直流电源的负极相连 | |
| B. | 电解时Pt电极上有H2放出 | |
| C. | 阴极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O | |
| D. | 电解一段时间后,硫酸溶液的pH不变化 |
| A. | 胶粒可以导电 | B. | 胶体是混合物 | ||
| C. | 胶体的分散剂为气体 | D. | 胶体粒子大小在1~100nm 之间 |
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
| 实验步骤 | 预期现象和结论 |
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).