题目内容
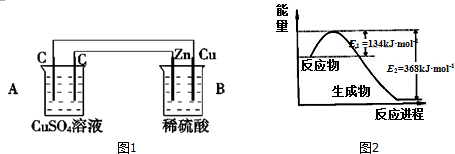
8. 对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )
对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )| A. | 电解时Pt电极应与直流电源的负极相连 | |
| B. | 电解时Pt电极上有H2放出 | |
| C. | 阴极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O | |
| D. | 电解一段时间后,硫酸溶液的pH不变化 |
分析 A、Pb合金上硝基苯发生还原反应得到HOC6H4NH2,所以左边是阴极,与电源的负极相连;
B、电解时Pt电极是阳极应水电离出的氢氧根离子放电,生成氧气放出;
C、阴极是发生还原反应;
D、电解一段时间后,右边是氢氧根离子放电生成氧气,而氢离子向左移动,导致硫酸溶液的浓度变大,溶液的PH值减小.
解答 解:A、Pb合金上硝基苯发生还原反应得到HOC6H4NH2,所以左边是阴极,与电源的负极相连,则电解时Pt电极应与直流电源的正极相连,故A错误;
B、电解时Pt电极是阳极应水电离出的氢氧根离子放电,生成氧气放出,而不是氢气,故B错误;
C、阴极是发生还原反应,阴极的电极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O,故C正确;
D、电解一段时间后,右边是氢氧根离子放电生成氧气,而氢离子向左移动,导致硫酸溶液的浓度变大,溶液的PH值减小,故D错误;
故选C.
点评 本题考查电化学的相关知识,学生要熟练掌握电化学反应的原理、电极反应式的书写和电极的连接方式等,比较容易.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
11.关于下列各图的叙述,正确的是( )
| A. | 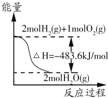 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| B. | 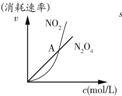 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 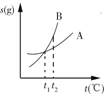 表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 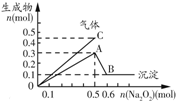 表示向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量的关系,则此溶液中n(Mg2+)、n(NH4+)、n(Al3+)的比为1:2:2 |
8.Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属单质混合物2.40g,用足量的澄清石灰水吸收CO2气体,得5.00g白色沉淀.则a可能为( )
| A. | 2.46 g | B. | 3.20 g | C. | 3.59 g | D. | 7.41 g |
20.下列有关原子及元素周期表的说法,错误的是( )
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
| A. | ①⑤⑥⑦ | B. | ①③⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②③④⑥⑧ |
17.无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列.按此规定,下列说法中错误的是( )
| A. | 第16、17列都是非金属元素 | |
| B. | 第1列金属元素和第17列元素的单质熔、沸点变化趋势相反 | |
| C. | 只有第2列元素原子最外层有2个电子 | |
| D. | 在18列元素中,第3列元素种类最多 |
18.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: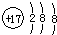 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | 乙醇的结构简式:C2H5OH |