题目内容
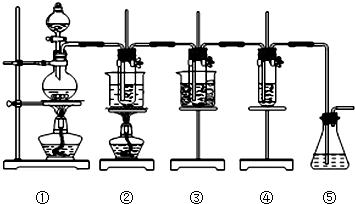
在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 图中:
①为氯气发生装置;
②的试管里盛有15mL 30% NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL 8% NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式 ;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol?L-1的浓盐酸混合加热,充分反应后生成的氯气
0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl质量为 .
(3)比较制取氯酸钠和次氯酸钠的条件,二者的差异是
① ;② .
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
①为氯气发生装置;
②的试管里盛有15mL 30% NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL 8% NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.请填写下列空白:

(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol?L-1的浓盐酸混合加热,充分反应后生成的氯气
(3)比较制取氯酸钠和次氯酸钠的条件,二者的差异是
①
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 |
考点:氯气的实验室制法,探究氯水、氯气的漂白作用
专题:
分析:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,可用饱和食盐水除杂;
(2)氯化氢易挥发,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;根据二氧化锰和作还原剂的HCl之间的关系式计算;
(3)在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色;
(2)氯化氢易挥发,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;根据二氧化锰和作还原剂的HCl之间的关系式计算;
(3)在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色;
解答:
解:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,所用反应仪器为分液漏斗和圆底烧瓶,生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:分液漏斗;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O(2分);C;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,所以反应生成氯气的物质的量小于0.06mol,17.4gMnO2的物质的量=
=0.2mol,该反应中二氧化锰和被氧化的HCl的物质的量之比为1:2,有0.2mol二氧化锰参加反应,则有0.4molHCl被氧化,m(HCl)=nM=0.4mol×36.5g/mol=142g,
故答案为:小于;142g;
(3)根据题中信息可知,在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同.
故答案为:①所用NaOH浓度不同;②反应控制的温度不同;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色,
故答案为:
| ||
故答案为:分液漏斗;MnO2+4HCl(浓)
| ||
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,所以反应生成氯气的物质的量小于0.06mol,17.4gMnO2的物质的量=
| 17.4g |
| 87g/mol |
故答案为:小于;142g;
(3)根据题中信息可知,在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同.
故答案为:①所用NaOH浓度不同;②反应控制的温度不同;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色,
故答案为:
| HClO有强氧化性,体现漂白作用是其褪色. | |
| 溶液颜色变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
点评:本题考查了氯气的实验室制法,明确氯气的有关化学反应原理是解本题关键,题目难度中等.

练习册系列答案
相关题目
下列实验操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、蒸馏石油时,应使温度计水银球放在蒸馏烧瓶的支管口处 |
| C、分液操作时,上层液体经分液漏斗下口放出 |
| D、为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
制备晶体硅的热方程式为 SiHCl3(l)+H2(g)=Si(s)+3HCl(g)△H=+238KJ/mol,
已知SiHCl3(l)=SiHCl3(g)△H=+10KJ/mol,相关键能数据如下表:则晶体硅的键能为( )
已知SiHCl3(l)=SiHCl3(g)△H=+10KJ/mol,相关键能数据如下表:则晶体硅的键能为( )
| SiHCl3(g) Si-H | SiHCl3(g) Si-Cl | H2(g) H-H | HCl(g) H-Cl | |
| 键能(KJ/mol) | 377 | 360 | 436 | 431 |
| A、186KJ/mol |
| B、181KJ/mol |
| C、372KJ/mol |
| D、362KJ/mol |
在容量瓶上,不会出现的标记是( )
| A、刻度线 | B、温度 | C、浓度 | D、容量 |

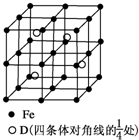 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.