题目内容
13.(1)1840年前后,瑞士科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”.现已知,在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1和393.5kJ•mol-1,则反应C(s)+2H2(g)=CH4(g)的反应热△H=-74.8kJ/mol,(2)已知:2H2(g)+O2(g)═2H2O(g)△H1
2H2(g)+O2(g)═2H2O(l)△H2
2CO(g)+O2(g)═2CO2(g)△H3
①写出液态水转化为气态水的热化学方程式:H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$.
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是$\frac{△{H}_{1}}{△{H}_{3}}$.
分析 (1)根据燃烧热写出热化学方程式,再根据盖斯定律计算得到所需热化学方程式;
(2)①根据已知方程式构建目标方程式,由$\frac{①-②}{2}$得H2O(l)═H2O(g)△H与化学计量数成正比;
②设得到相同热量,放出的热量为Q,根据CO和H2燃烧的方程式中物质的量与热量之间的关系求解.
解答 解:(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol、-393.5kJ/mol,它们的热化学反应方程式分别为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
根据盖斯定律,由③+②×2-①得,C(s)+2H2(g)=CH4(g),△H=[(-393.5kJ/mol)+(-285.8kJ/mol)×2]-(-890.3kJ/mol)=-74.8kJ/mol,
故答案为:-74.8kJ/mol.
(2)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
②C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8KJ/mol;故答案为:-74.8KJ/mol;
(2)①2H2(g)+O2(g)═2H2O(g)△H1
②2H2(g)+O2(g)═2H2O(l)△H2
由$\frac{①-②}{2}$得,H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$,
故答案为:H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;
②设得到相同热量,放出的热量为Q,由2H2(g)+O2(g)═2H2O(g)△H1得需要H2的物质的量$\frac{2Q}{△{H}_{1}}$,由2CO(g)+O2(g)═2CO2(g)△H3得需要CO的物质的量为$\frac{2Q}{△{H}_{3}}$,所需CO和H2的体积比=物质的量之比是$\frac{△{H}_{1}}{△{H}_{3}}$,
故答案为:$\frac{△{H}_{1}}{△{H}_{3}}$.
点评 本题主要考查了燃烧热、热化学方程式的书写、盖斯定律的运用以及化学计算,熟练掌握盖斯定律的计算应用是关键,题目难度中等.

| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
| A. | SO2 | B. | N2 | C. | CO2 | D. | NH3 |
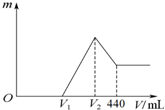
| A. | V2=400mL | |
| B. | 0≤V1<280mL | |
| C. | 加入NaOH溶液的过程中,产生沉淀的最大量可能为0.18mol | |
| D. | 当V1=160mL时,n(Mg)=0.04mol |
I:实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、玻璃棒、量筒、外还需的玻璃仪器是胶头滴管、100ml的容量瓶.
(2)下列有关配制过程中说法正确的是aef(填序号).
a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.用托盘天平称量质量为1.9g的FeBr2
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏低
f.容量瓶查漏后没有干燥就进行配制,结果无影响
II:探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成表,验证假设:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量苯,振荡、静置后 现象:CCl4层呈橙红色. | 假设1正确 |
| ②向溶液中加入KSCN溶液溶液 现象:溶液变为红色. | 假设2正确 |
请用一个离子方程式来证明:2Fe2++Br2=2Fe3++2Br-;
(5)若在50mL上述FeBr2溶液中通入5×10-3molCl2,则反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
| A. | 盐酸 | B. | FeCl3溶液 | C. | 溴水 | D. | 四氯化碳 |
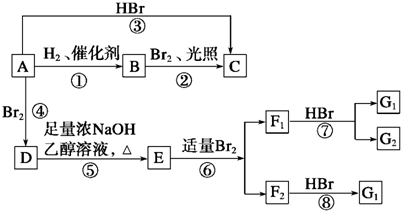
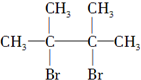 .
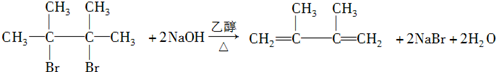
.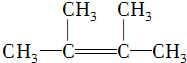 ,其名称为2,3-二甲基-2-丁烯.
,其名称为2,3-二甲基-2-丁烯. .
. ;写出由E→F2的化学方程式
;写出由E→F2的化学方程式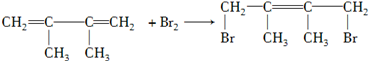 .
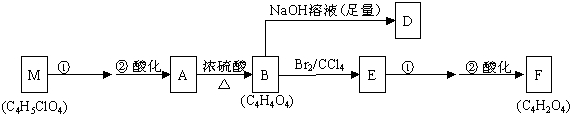
.
 +n HOCH2CH2OH$\stackrel{一定条件}{→}$
+n HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.