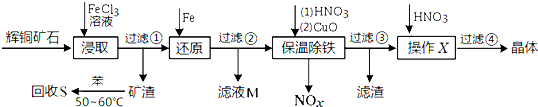
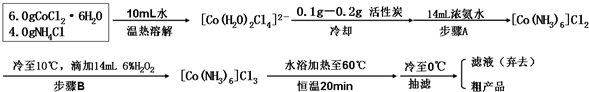
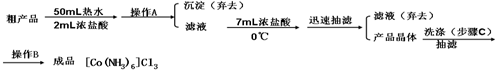
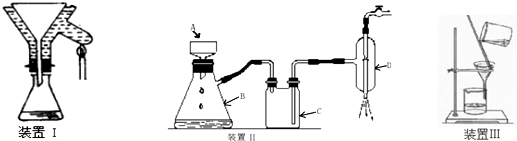
题目内容
反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每1mol CuSO4能氧化P的物质的量为( )
| A、0.2 mol |
| B、0.4 mol |
| C、0.6mol |
| D、2.2 mol |
考点:氧化还原反应
专题:
分析:反应中Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P0.2mol.
解答:
解:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为
=3mol,则1molCuSO4氧化P
mol,即0.2mol.
故选A.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为
| 15 |
| 5 |
| 1 |
| 5 |
故选A.
点评:本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列离子方程式正确的是( )
| A、三氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2═10Cl-+4I2+2Fe3+ |
| C、K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3-+6HCl═37Cl-+3Cl2↑+3H2O |
| D、将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32-═CO2↑+H2O |
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是( )
| A、2H++2e-→H2 |
| B、Fe2++3e→Fe |
| C、2H2O+O2+4e-→4OH- |
| D、Fe3+-e→Fe3+ |
在实验室中,从碘水中提取碘的操作,正确的是( )
| A、分液、蒸馏 |
| B、溶解、过滤、蒸发 |
| C、萃取、分液 |
| D、萃取、分液、蒸馏 |
下列关于蒸馏操作的有关叙述不正确的是( )
| A、蒸馏操作时蒸馏烧瓶要垫上石棉网 |
| B、蒸馏操作使用的温度计的水银球应插入到液体内 |
| C、在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸 |
| D、冷凝管进出水的方向是下口进水、上口出水 |