题目内容
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如图:
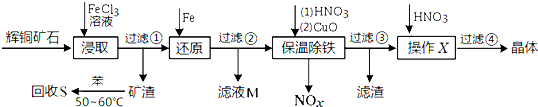
(1)写出步骤“还原”中可能发生反应的离子方程式 、 .
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 .
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质.
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.硝酸的作用是 ;操作X是 、 (填操作名称).

(1)写出步骤“还原”中可能发生反应的离子方程式
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.硝酸的作用是
考点:铜金属及其重要化合物的主要性质,制备实验方案的设计
专题:实验题
分析:(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,据此解答即可;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(5)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质;铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,据此解答即可.
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(5)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质;铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,据此解答即可.
解答:
解:(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,反应的离子反应方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,故答案为:Fe+2Fe3+=3Fe2+;Fe+Cu2+=Cu+Fe2+;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;故答案为:苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,HNO3可以循环使用,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用,故选b;
故答案为:HNO3;b;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,
故答案为:调节溶液PH;使使铁元素完全转化为氢氧化铁沉淀;
(5)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质;铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,
故答案为:抑制Cu2+的水解;蒸发浓缩;冷却结晶.
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;故答案为:苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,HNO3可以循环使用,向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用,故选b;
故答案为:HNO3;b;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,
故答案为:调节溶液PH;使使铁元素完全转化为氢氧化铁沉淀;
(5)加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质;铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,
故答案为:抑制Cu2+的水解;蒸发浓缩;冷却结晶.
点评:本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每1mol CuSO4能氧化P的物质的量为( )
| A、0.2 mol |
| B、0.4 mol |
| C、0.6mol |
| D、2.2 mol |
根据表中提供的数据判断下列说法不正确的是( )
| 化学式 | 电离常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A、等浓度等体积的NaCN、NaHCO3溶液混合:c(Na+)+c(H+)=c(HCO3-)+c(CN-)+c(OH-)+2c(CO32-) | ||
B、若NaCN的水解平衡常数为:Kh=
| ||
| C、等浓度等体积的NaCN和NaCl溶液中离子数目前者大于后者 | ||
| D、过量CO2通入NaCN溶液中:CO2+H2O+CN-=HCO3-+HCN |


 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;