题目内容
12.有关FeSO4的转化关系如图所示(无关物质已略去).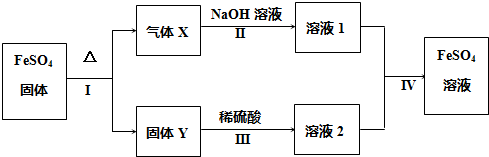
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀;
②Y是红棕色的化合物.
(1)气体X的成分是SO2、SO3(填化学式).
(2)若经反应I得到16g固体Y,产生的气体X恰好被0.4L 1mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是SO32-+2Fe3++H2O═SO42-+2Fe2++2H+.
(3)向FeSO4溶液中加入某一物质可变成溶液2且不引入任何杂质,写出该过程的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)溶液2中金属阳离子的检验方法是取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变为血红,则证明原溶液中含有Fe3+.
分析 硫酸亚铁分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3.
解答 解:硫酸亚铁分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3.
(1)气体X的成分是:SO2、SO3,
故答案为:SO2、SO3;
(2)Y为Fe2O3,物质的量为$\frac{16g}{160g/mol}$=0.1mol,产生的气体X为SO2、SO3,根据电子转移守恒生成为SO2为$\frac{0.1mol×2×(3-1)}{(6-4)}$=0.1mol,结合Fe、S原子物质的量为1:1可知生成SO3为0.1mol,产生的气体X恰好被0.4L 1mol/L NaOH溶液完全吸收,NaOH物质的量为0.4mol,则发生反应:2NaOH+SO2═Na2SO3+H2O,2NaOH+SO3═Na2SO4+H2O,生成Na2SO3、Na2SO4均为0.1mol,则反应IV中为Na2SO3与Fe2(SO4)3溶液发生氧化还原反应,反应离子方程式为:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+,
故答案为:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+;
(3)向FeSO4溶液中加入某一物质可变成溶液2且不引入任何杂质,应是加入过氧化氢,该过程的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)溶液2中金属阳离子是由Fe2O3溶于稀硫酸得到,反应方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,检验溶液2中金属阳离子,实际就是检验溶液中的Fe3+离子,检验方法为:取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变为血红,则证明原溶液中含有Fe3+,
故答案为:取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变为血红,则证明原溶液中含有Fe3+.
点评 本题为框图型的物质推断题,需要学生熟练掌握元素化合物知识,是对学生综合能力的考查,注意掌握铁离子与亚铁离子的检验方法.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |

| A. | ②④ | B. | ③④⑤ | C. | ①④⑧ | D. | ②④⑥⑦ |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O,上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(6)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.
| A. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| B. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O | |
| C. | 向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时离子方程式科表示为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn 2++7O2↓+10H2O |
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: