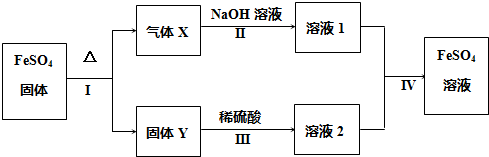
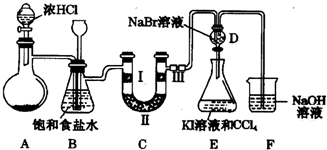
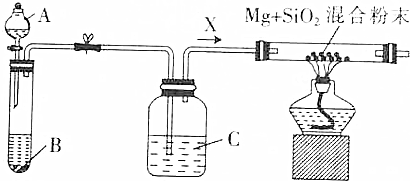
题目内容
2.下列离子方程式表达不正确的是( )| A. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| B. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O | |
| C. | 向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时离子方程式科表示为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn 2++7O2↓+10H2O |
分析 A.亚铁离子具有较强还原性,能够与氧气反应生成铁离子;
B.氢氧化镁的碱性大于一水合氨,能够与氯化铵反应生成一水合氨和氯化镁;
C.沉淀最大时,硫酸根离子完全转化成硫酸钡沉淀,铝离子与氢氧根离子的物质的量之比为1:4,氢氧化铝完全溶解;
D.4mol高锰酸根离子完全转化成锰离子,得到20mol电子,而4mol双氧水反应失去8mol电子,不满足电子守恒.
解答 解:A.在硫酸亚铁溶液中通入氧气,亚铁离子被氧化,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故A正确;
B.氢氧化镁碱性大于一水合氨,可用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁,反应的离子方程式为:Mg(OH)2+2NH4+=Mg2++2NH3•H2O,故B正确;
C.向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时,硫酸根离子完全沉淀,此时铝离子与氢氧根离子按照1:4反应,恰好生成偏铝酸根离子,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故C正确;
D.氧化还原反应型的离子方程式必须满足电子守恒,正确的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故D错误;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,44.8L苯中所含分子数为2NA | |
| B. | 标准状况下,11.2L的12C16O和14N2混合气体所含中子数和原子数的差值为6NA | |
| C. | 常温下,1L pH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| D. | 2mol Cl2通入足量的水中转移电子数目为2NA |
3.天然存在的金属钫(Fr)极微量.它是碱金属元素中最重的元素,已知其21个同位素都有放射性.根据它在周期表中的位置预言其性质,其中不正确的是( )
| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 其单质的熔点比金属钠的熔点低 |
20.下列反应中同时有离子键和共价键的断裂和形成的反应是( )
| A. | NH4Cl═NH3+HCl | B. | H2+Cl2═2HCl | ||
| C. | N2+3H2═2NH3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |