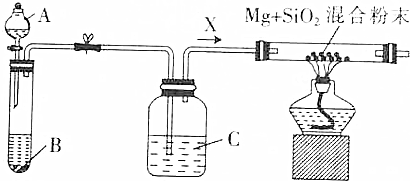
题目内容
7. 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为:3X+Y?2Z.
(2)反应开始至2min,用Z表示的平均反应速率为:0.05mol/(L•min);.
(3)下列叙述能说明上述反应达到化学平衡状态的是AB(填序号).
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZC.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amol X(g)和bmol Y(g),发生反应X(g)+Y(g)=2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①在其它条件不变时降低温度:减小;
②在其它条件不变时加入催化剂:增大;
③在其它条件不变时加入一定量的Z气体:增大.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(3)反应物和生成物物质的量不再变化说明反应达到平衡状态,此时正逆反应速率相同;
(4)根据外界条件对化学反应速率的影响因素可知,升高温度、增大压强、使用催化剂等都可以使反应速率增大,反之则减小反应速率,据此判断.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)图象可知Z的消耗物质的量为0.2mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
(3)A.混合气体的总物质的量不随时间的变化而变化,说明各物质的量不变反应达平衡状态,故正确;
B.混合气体的压强不随时间的变化而变化,说明各物质的量不变反应达平衡状态,故正确;
C.只要反应发生就符合单位时间内每消耗3molX,同时生成2molZ,故错误;
D.混合气体的总质量一直不随时间的变化而变化,故错误;
故选AB;
(4)根据外界条件对化学反应速率的影响因素可知,升高温度、增大压强、使用催化剂等都可以使反应速率增大,反之则减小反应速率,所以①降低温度则减小反应速率,②加入催化剂增大反应速率,③在其它条件不变时加入一定量的Z气体,生成物浓度越大反应速率越快,故答案为:①减小②增大③增大.
点评 本题考查了化学反应速率、化学平衡状态判断,主要是概念的计算应用,掌握基础是解题关键,题目较简单.

 应用题作业本系列答案
应用题作业本系列答案| A. | C2H4 和C2H6 | B. | CH4和C3H6 | C. | C3H8和C2H4 | D. | CH4 和C2H4 |
| A. | 数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为14NA | |
| D. | 2.3g Na完全反应时,转移电子的数目为0.1 NA |
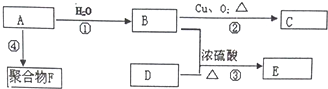
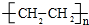 .
.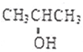 化学性质与B相似,试写出
化学性质与B相似,试写出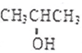 在有催化剂和加热条件下与O2反应的化学方程式:2
在有催化剂和加热条件下与O2反应的化学方程式:2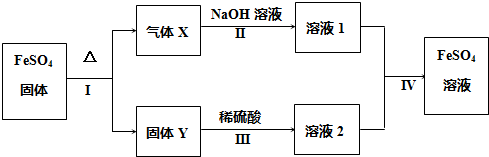
 .
.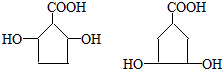 .
.