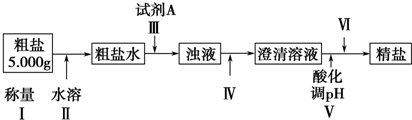
题目内容
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了测定其纯度,用浓度为0.1152mol/L的盐酸标准溶液进行滴定.试回答下列问题:
(1)用电子天平称量3.200g固体试剂,再用蒸馏水在烧杯中充分溶解并冷却至室温后,用玻璃棒引流转入500mL容量瓶中,恰好至刻度线,振荡、摇匀即配成待测液备用.请指出以上操作中出现的错误有 .
(2)将标准盐酸装在50.00mL (填“酸式”或“碱式”)滴定管中,调节液面位置使其在 处,并记下刻度.
(3)取25.00mL待测液并加入指示剂待测定.该项实验操作需要的主要仪器 .
(4)下列实验操作中,会引起测定结果偏低的(填字母) .
A.转移待测液至容量瓶时,末洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
(5)某同学所得实验数据如下表所示,据此,请写出上述固体试剂中NaOH的质量分数的计算式(不要化简) .
(1)用电子天平称量3.200g固体试剂,再用蒸馏水在烧杯中充分溶解并冷却至室温后,用玻璃棒引流转入500mL容量瓶中,恰好至刻度线,振荡、摇匀即配成待测液备用.请指出以上操作中出现的错误有
(2)将标准盐酸装在50.00mL
(3)取25.00mL待测液并加入指示剂待测定.该项实验操作需要的主要仪器
(4)下列实验操作中,会引起测定结果偏低的(填字母)
A.转移待测液至容量瓶时,末洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
(5)某同学所得实验数据如下表所示,据此,请写出上述固体试剂中NaOH的质量分数的计算式(不要化简)
| 实验编号 | 盐酸的浓度/mol?L-1 | 滴定完成时,盐 酸滴入的体积/mL | 待测NaOH溶液 的体积/mL |
| 1 | 0.1152 | 26.72 | 25.00 |
| 2 | 0.1152 | 29.02 | 25.00 |
| 3 | 0.1152 | 26.70 | 25.00 |
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)烧杯应洗涤,定容应用胶头滴管定容;
(2)盐酸应用酸式滴定管量取,装液后要调整液面“0”或“0”以下的某一刻度;
(3)待测液为NaOH,选择碱式滴定管;
(4)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(5)根据第一次和第三次次实验消耗的盐酸的平均体积,求出平均物质的量,即等于氢氧化钠的物质的量,再根据氢氧化钠溶液的体积为25ml,可知原来500ml溶液中氢氧化钠的物质的量,再根据m=n?M即可求出质量,再根据样品的质量为3.20g,即可求出质量分数.
(2)盐酸应用酸式滴定管量取,装液后要调整液面“0”或“0”以下的某一刻度;
(3)待测液为NaOH,选择碱式滴定管;
(4)根据c=
| n |
| V |
(5)根据第一次和第三次次实验消耗的盐酸的平均体积,求出平均物质的量,即等于氢氧化钠的物质的量,再根据氢氧化钠溶液的体积为25ml,可知原来500ml溶液中氢氧化钠的物质的量,再根据m=n?M即可求出质量,再根据样品的质量为3.20g,即可求出质量分数.
解答:
解:(1)烧杯没有洗涤,会导致所配溶液浓度偏低;定容时应用胶头滴管定容,故答案为:烧杯未洗涤,未用胶头滴管定容;
(2)盐酸应用酸式滴定管量取,装液后要调整液面“0”或“0”以下的某一刻度,故答案为:酸式;“0”或“0”以下的某一刻度;
(3)待测液为NaOH,选择碱式滴定管或移液管,故答案为:碱式滴定管;
(4)A.转移待测液至容量瓶时,末洗涤烧杯,会导致溶质的损失,则所配溶液的浓度偏低,故A选;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,会导致盐酸被稀释,消耗的盐酸的体积增大,故引起所测的待测液的浓度偏高,故B不选;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,导致所消耗的标准液的量偏小,故引起所测的待测液的浓度偏低,故C选;
D.滴定到终点时,滴定管尖嘴悬有液滴,会导致消耗的标准液的量偏大,故引起所测的待测液的浓度偏高,故D不选.
故选AC.
(5)根据三次实验消耗盐酸可以看出,舍去第二次实验的结果,将第一次和第三次的体积,即平均消耗的盐酸的物质的量n=C?V=
×10-3×0.1152mol/L
根据H++OH-=H2O可知25mlNaOH溶液中NaOH的物质的量n=
×10-3×0.1152mol/L
故500mlNaOH溶液中NaOH的物质的量n=
×10-3×0.1152mol/L×
故质量m=n?M=
×10-3×0.1152mol/L×
×40g/mol
故样品的质量分数ω(NaOH)%=
×100%,
故答案为:ω(NaOH)%=
×100%.
(2)盐酸应用酸式滴定管量取,装液后要调整液面“0”或“0”以下的某一刻度,故答案为:酸式;“0”或“0”以下的某一刻度;
(3)待测液为NaOH,选择碱式滴定管或移液管,故答案为:碱式滴定管;
(4)A.转移待测液至容量瓶时,末洗涤烧杯,会导致溶质的损失,则所配溶液的浓度偏低,故A选;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,会导致盐酸被稀释,消耗的盐酸的体积增大,故引起所测的待测液的浓度偏高,故B不选;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,导致所消耗的标准液的量偏小,故引起所测的待测液的浓度偏低,故C选;
D.滴定到终点时,滴定管尖嘴悬有液滴,会导致消耗的标准液的量偏大,故引起所测的待测液的浓度偏高,故D不选.
故选AC.
(5)根据三次实验消耗盐酸可以看出,舍去第二次实验的结果,将第一次和第三次的体积,即平均消耗的盐酸的物质的量n=C?V=
| 26.72ml+26.71ml |
| 2 |
根据H++OH-=H2O可知25mlNaOH溶液中NaOH的物质的量n=
| 26.72ml+26.71ml |
| 2 |
故500mlNaOH溶液中NaOH的物质的量n=
| 26.72ml+26.71ml |
| 2 |
| 500ml |
| 25ml |
故质量m=n?M=
| 26.72ml+26.71ml |
| 2 |
| 500ml |
| 25ml |
故样品的质量分数ω(NaOH)%=
| ||||
| 3.2g |
故答案为:ω(NaOH)%=
| ||||
| 3.2g |
点评:本题考查了一定物质的量浓度溶液的配制和酸碱中和滴定过程中的仪器的选用、误差的分析以及质量分数的测定,综合性较强,难度较大.

练习册系列答案
相关题目
以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2(g)+
O2(g)→2CO2(g)+H2O(l)△H=-1300kJ/mol的说法中,正确的是( )
| 5 |
| 2 |
| A、当10NA个电子转移时,该反应放出1300kJ的能量 |
| B、当1NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、当2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、当6NA个碳氧共用电子对生成时,放出1300kJ的能量 |
将a g铁和氧化铁的混合物加入800mL pH=1的盐酸中充分反应后,固体无剩余,盐酸全部消耗,放出标准状况下气体 0.224L.则下列判断中正确的是( )
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入无色的KSCN溶液,显血红色 |
| C、无法计算出原混合物的质量 |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A、图中AB段的氧化剂为K2Cr2O7 |
| B、图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C、开始加入的K2Cr2O7为0.25 mol |
| D、K2Cr2O7可与FeSO4反应的物质的量为1:3 |
A、B、C、D 为4种金属.将A、B分别加入等浓度稀盐酸中,B比A反应更剧烈.将A、D用导线连结,同时浸入稀硫酸中,D表面出现大量气泡.将D浸入C的盐溶液中,有C析出.则其金属活动性由强到弱的顺序是( )
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
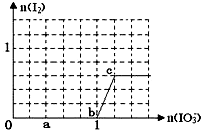 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题: