题目内容
下列溶液中物质的量浓度肯定为1mol/L的是( )
| A、将40g NaOH固体溶解于1L水中 |
| B、将22.4L氯化氢气体溶于水配成1L溶液 |
| C、将1L 10 mol/L浓盐酸与10L水混合 |
| D、10g NaOH固体溶解在水中配成250mL溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、溶液的体积不等于溶剂的体积;
B、22.4L氯化氢气体的物质的量不一定等于1mol;
C、混合溶液的体积不等于10L;
D、10g NaOH的物质的量为0.25mol,溶液的体积为0.25L.
B、22.4L氯化氢气体的物质的量不一定等于1mol;
C、混合溶液的体积不等于10L;
D、10g NaOH的物质的量为0.25mol,溶液的体积为0.25L.
解答:
解:A、40g NaOH的物质的量为1mol,溶液的体积不等于溶剂的体积,溶液的体积不是1L,因此溶液中物质的量浓度不是1mol/L,故A错误;
B、22.4L氯化氢气体的物质的量不一定等于1mol,因此溶液中物质的量浓度不是1mol/L,故B错误;
C、混合溶液的体积不等于10L,根据稀释定律可知混合液的物质的量浓度不是1mol/L,故C错误;
D、10g NaOH的物质的量为0.25mol,溶液的体积为0.25L,因此溶液中物质的量浓度是1mol/L,故D正确;
故选D.
B、22.4L氯化氢气体的物质的量不一定等于1mol,因此溶液中物质的量浓度不是1mol/L,故B错误;
C、混合溶液的体积不等于10L,根据稀释定律可知混合液的物质的量浓度不是1mol/L,故C错误;
D、10g NaOH的物质的量为0.25mol,溶液的体积为0.25L,因此溶液中物质的量浓度是1mol/L,故D正确;
故选D.
点评:本题考查了物质的量浓度,题目难度不大,注意溶液的体积不等于溶剂的体积,不等于溶剂的体积加上溶质的体积.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
共价键、离子键、金属键、分子间作用力都是微粒间的作用力,含有以上两种作用力的晶体是( )
| A、HCl | B、金刚石 |
| C、NaOH | D、Na |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| C、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| D、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
A、B、C、D 为4种金属.将A、B分别加入等浓度稀盐酸中,B比A反应更剧烈.将A、D用导线连结,同时浸入稀硫酸中,D表面出现大量气泡.将D浸入C的盐溶液中,有C析出.则其金属活动性由强到弱的顺序是( )
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,下列说法正确的是( )
| A、1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和 |
| B、1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和 |
| C、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值大于297.23 |
| D、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值等于297.23 |
下列有关实验操作正确的是( )
A、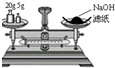 称量氢氧化钠固体 |
B、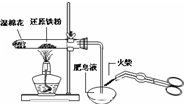 检验铁粉与水蒸气反应产生的氢气 |
C、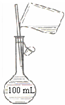 配制150 mL 0.10 mol/L盐酸 |
D、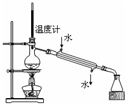 分离两种互溶但沸点相差较大的液体混合物 |
相同温度下,体积均为1.5L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得有关数据如表:
下列叙述不正确的是( )
X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得有关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A、容器①中达到平衡时,Y2的转化率为50% |
| B、Q=27.78kJ |
| C、若X2、Y2、XY3改按0、0、2投料,则达到平衡时吸热46.3KJ |
| D、若容器①体积改为1.0L.则达平衡时放出的热量小于46.3kJ |