题目内容
 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的FeCl3溶液.最后可用一定浓度的K2Cr2O7酸性溶液滴定生成的Fe2+,此时还原产物为Cr3+.现有锡合金试样1.23g,经上述反应、操作后,共用去0.200mol/L的K2Cr2O7的酸性溶液15.00mL.
(1)列式计算样品中锡的质量分数.
(2)用上述样品模拟工业上电解精炼锡,如图:b极发生电极反应式
考点:氧化还原反应的计算,电解原理
专题:计算题,电化学专题
分析:(1)由电子守恒可知,6Fe2+~3Sn2+~Cr2O72-,以此计算Sn的质量分数;
(2)电解精炼锡,b与正极相连,为阳极,Sn、Zn失去电子;阴极上析出Sn,电解质溶液质量减轻0.54g,即为Sn与Zn的质量差,以此计算.
(2)电解精炼锡,b与正极相连,为阳极,Sn、Zn失去电子;阴极上析出Sn,电解质溶液质量减轻0.54g,即为Sn与Zn的质量差,以此计算.
解答:
解:(1)由电子守恒可知,6Fe2+~3Sn2+~Cr2O72-,
n(Sn2+)=15×10-3L×0.2mol/L×3=0.009mol,
则样品中锡的质量分数为
×100%=87.1%,
答:样品中锡的质量分数为87.1%;
(2)电解精炼锡,b与正极相连,为阳极,Sn、Zn失去电子,阳极反应式为Sn-2e-=Sn2+、Zn-2e-=Zn2+;阴极上析出Sn,阴极反应式为Sn2++2e-=Sn,由当得到11.90g纯锡可知电解过程中转移电子为0.2mol,电解质溶液质量减轻0.54g,即为Sn与Zn的质量差,由转移2mol电子质量差为54g,则质量差为0.54g转移电子为0.02mol,应该溶解的Zn为0.01mol、溶解Sn0.09mol,而样品中锡的质量分数为87.1%,所以锡合金质量减少应该为
=12.3g,
故答案为:Sn-2e-=Sn2+、Zn-2e-=Zn2+;12.3.
n(Sn2+)=15×10-3L×0.2mol/L×3=0.009mol,
则样品中锡的质量分数为
| 0.009mol×119g/mol |
| 1.23g |
答:样品中锡的质量分数为87.1%;
(2)电解精炼锡,b与正极相连,为阳极,Sn、Zn失去电子,阳极反应式为Sn-2e-=Sn2+、Zn-2e-=Zn2+;阴极上析出Sn,阴极反应式为Sn2++2e-=Sn,由当得到11.90g纯锡可知电解过程中转移电子为0.2mol,电解质溶液质量减轻0.54g,即为Sn与Zn的质量差,由转移2mol电子质量差为54g,则质量差为0.54g转移电子为0.02mol,应该溶解的Zn为0.01mol、溶解Sn0.09mol,而样品中锡的质量分数为87.1%,所以锡合金质量减少应该为
| 0.09×119g/mol |
| 87.1% |
故答案为:Sn-2e-=Sn2+、Zn-2e-=Zn2+;12.3.
点评:本题考查氧化还原反应及电解原理的计算,为高频考点,把握氧化还原反应中电子守恒及电极反应为解答的关键,(2)中质量差分析为解答的难点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物与氧气充分反应,转移的电子数为0.3NA |
| C、一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
利用如图装置,可完成很多电化学实验.下列有关叙述,正确的是( )
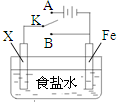

| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
为探究Fe2+对O3氧化I-反应的影响,某研究小组测定两组实验中I3-浓度和体系pH,结果见以下图表.

下列说法不正确的是( )

下列说法不正确的是( )
A、在溶液中存在化学平衡I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为
| ||||
| B、第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降 | ||||
| C、3-18s内第2组实验中生成I3-的平均反应速率约为0.55mol/(L?s) | ||||
| D、Fe2+可作为O3氧化I-的催化剂 |
下列化学用语正确的是( )
A、苯的分子式为  |
B、HF的形成过程 |
C、四氯化碳的电子式  |
D、硫离子结构示意图  |
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)