题目内容
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中.钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液.
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: .
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”).
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00mol?L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程.
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液.
(1)上述步骤②中的水解反应方程式为
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00mol?L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)氟硅酸钾(K2SiF6)沉淀于热水中水解,生成HF、H2SiO3、KF,结合原子守恒书写化学方程式;步骤③中反应是过滤除去硅酸沉淀后用氢氧化钠溶液滴定生成的HF溶液,发生的反应书写离子方程式;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大;
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml,结合反应过程中的定量关系计算.
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大;
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml,结合反应过程中的定量关系计算.
解答:
解:(1)氟硅酸钾(K2SiF6)沉淀于热水中水解,生成HF、H2SiO3、KF,结合原子守恒书写化学方程式,反应的化学方程式为:K2SiF6+3H2O=2KF+H2SiO3+4HF;步骤③中反应是过滤除去硅酸沉淀后用氢氧化钠溶液滴定生成的HF溶液,反应的离子方程式 HF+OH-=F-+H2O,
故答案为:K2SiF6+3H2O=2KF+H2SiO3+4HF;HF+OH-=F-+H2O;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大,结果偏高,
故答案为:偏高;
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml;
关系式:SiO2~Si~4HF~4NaOH
60g 4mol
m(SiO2) 20.00×10-3L×1.0mol?L-1
求得m(SiO2)=0.30g
硅元素的质量分数(以二氧化硅计):
×100%=30%,
答:该试样中硅元素的质量分数为30%.
故答案为:K2SiF6+3H2O=2KF+H2SiO3+4HF;HF+OH-=F-+H2O;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大,结果偏高,
故答案为:偏高;
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml;
关系式:SiO2~Si~4HF~4NaOH
60g 4mol
m(SiO2) 20.00×10-3L×1.0mol?L-1
求得m(SiO2)=0.30g
硅元素的质量分数(以二氧化硅计):
| 0.30g |
| 1.00g |
答:该试样中硅元素的质量分数为30%.
点评:本题考查了化学方程式和离子方程式书写方法,滴定实验过程的分析计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
对100mL 1mol?L-1的Na2CO3溶液,下列说法不正确的是( )
A、将溶液稀释,
| ||
| B、滴入含0.1 mol CH3COOH的溶液:c(CH3COO-)<c(HCO3-) | ||
| C、通入0.1 mol CO2气体,溶液中存在:c(Na+)=c(CO32-)十c(HCO3-)+c(H2CO3) | ||
| D、滴入酚酞,微热,溶液颜色加深 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=l的溶液中:Ca2+、Fe2+,NO3- |
| B、c(OH-)=10-2的溶液中:Na+、AlO2-、Cl- |
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、SCN-、SO42- |
| D、由水电离的c(H+)=1×10-14 mol?L-1的溶液中;Na+、AlO2-、CO32- |
下列有关电解质的电离和水解说法正确的是( )
| A、在25℃时,任何水溶液中KW=1×10-14 |
| B、在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| C、在PH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液PH=3 |
| D、0.1mol?L-1醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为 NA |
| B、常温常压下,1.70g NaNO3含有的Na+离子数为0.02 NA |
| C、通常状况下,0.5 NA 个CO分子占有的体积为11.2 L |
| D、物质的量浓度为0.5mol?L-1的MgBr2溶液中,含有Br-个数为NA |
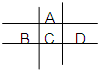 图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:
图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题: 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应. 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题: