题目内容
下列化学用语正确的是( )
A、苯的分子式为  |
B、HF的形成过程 |
C、四氯化碳的电子式  |
D、硫离子结构示意图  |
考点:分子式,电子式,原子结构示意图
专题:化学用语专题
分析:A.分子式是用元素符号表示纯净物(单质、化合物)分子的组成及相对分子质量的化学式;
B.共价化合物是原子间通过共用电子对结合而成的.书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出.因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子;
C.四氯化碳是共价化合物,氯原子未成键的孤对电子对未画出;
D.硫离子核内质子数为16,核外电子数为18,其结构示意图: .
.
B.共价化合物是原子间通过共用电子对结合而成的.书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出.因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子;
C.四氯化碳是共价化合物,氯原子未成键的孤对电子对未画出;
D.硫离子核内质子数为16,核外电子数为18,其结构示意图:
 .
.解答:
解:A.苯的分子式为C6H6,故A错误;
B.HF是共价化合物, ,故B错误;
,故B错误;
C.氯原子未成键的孤对电子对未画出,四氯化碳是共价化合物,碳原子与氯原子之间形成1对共用电子对,电子式为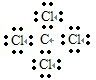 ,故C错误;
,故C错误;
D.硫离子核内质子数为16,核外电子数为18,其结构示意图: ,故D正确.
,故D正确.
故选D.
B.HF是共价化合物,
 ,故B错误;
,故B错误;C.氯原子未成键的孤对电子对未画出,四氯化碳是共价化合物,碳原子与氯原子之间形成1对共用电子对,电子式为
 ,故C错误;
,故C错误;D.硫离子核内质子数为16,核外电子数为18,其结构示意图:
 ,故D正确.
,故D正确.故选D.
点评:本题考查常用化学用语的书写,难度不大,要熟练掌握常用的化学用语,注意不同化学用语的书写要求.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于4区的是( )


| A、Cl2+2KBr═Br2+2KCl |
| B、2NaHCO3?Na2CO3+H2O+CO2 |
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| D、2Na2O2+2CO2═2Na2CO3+O2 |
某同学按图所示的装置进行电解实验,下列说法错误的是( )


| A、电解初期,石墨电极上有H2产生 | ||||
| B、整个电解过程中,H+的浓度不断增大 | ||||
| C、电解一定时间后,石墨电极上有铜析出 | ||||
D、电解初期,总反应方程式为:Cu+H2SO4
|
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为 NA |
| B、常温常压下,1.70g NaNO3含有的Na+离子数为0.02 NA |
| C、通常状况下,0.5 NA 个CO分子占有的体积为11.2 L |
| D、物质的量浓度为0.5mol?L-1的MgBr2溶液中,含有Br-个数为NA |
HA为一元弱酸,在0.1mol?L-1 NaA溶液中,下列说法正确的是( )
| A、室温下,该溶液的pH=7 |
| B、适当加热该溶液,溶液的PH值升高 |
| C、c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、c(Na+)+c(H+)=c(A-)+c(OH-) |
下列表达式书写正确的是( )
| A、CaCO3的电离方程式:CaCO3=Ca2++CO32- |
| B、HCO3-的电离方程式:HCO3-+H2O═H3O++CO32- |
| C、CO32-的水解方程式:CO32-+2H2O═H2CO3+2OH- |
| D、CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO32-(aq) |
 某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的
某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸:Sn+2HCl=SnCl2+H2↑,过滤,洗涤.将滤液和洗涤液合并再加过量的