��Ŀ����
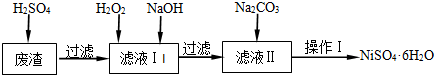
��ҵ���ۺ����û�ͭ��CuFeS2���Ʊ���ˮ���������ƣ�Na2FeO4����ͭ���仯����Ĺ�ҵ������ͼ��ʾ��
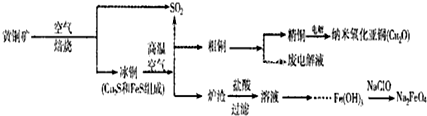
��1��ұ��ͭ�ķ�ӦΪ8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO������CuFeS2��Ԫ�صĻ��ϼ�Ϊ+2��
1molCuFeS2���뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ mol��
��2������¯������Fe2O3��FeO��SiO2��Al2O3���Ʊ��������Ƶķ���Ϊ��
����ϡ�����ȡ¯�������ˣ�
������Һ�м�������H2O2��Һ���ټ�������NaOH��Һ�����ˣ�������ϴ�ӡ������Fe��0H��3��
��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ�
a��д����ȡ�������ƵĻ�ѧ����ʽ�� ��
b����֤¯���к���FeO��Ҫ�Ļ�ѧ�Լ�Ϊ ��
��3���Ʊ�����������ͭ��Cu2O��ʱ��ͭ����ʯī���缫������ʳ��ˮ������ʣ���ⷴӦΪ2Cu+H2O
Cu2O+H2����ͭ���Ϸ����ĵ缫��ӦʽΪ ��
��4��ֱ���ŷź�SO2���������γ����꣬Σ����������NaOH��Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ�����
������Һ������ʱ����Һ������Ũ���ɴ�С��˳��Ϊ�� ��

��1��ұ��ͭ�ķ�ӦΪ8CuFeS2+21O2
| ||
1molCuFeS2���뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ
��2������¯������Fe2O3��FeO��SiO2��Al2O3���Ʊ��������Ƶķ���Ϊ��
����ϡ�����ȡ¯�������ˣ�
������Һ�м�������H2O2��Һ���ټ�������NaOH��Һ�����ˣ�������ϴ�ӡ������Fe��0H��3��
��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ�
a��д����ȡ�������ƵĻ�ѧ����ʽ��
b����֤¯���к���FeO��Ҫ�Ļ�ѧ�Լ�Ϊ
��3���Ʊ�����������ͭ��Cu2O��ʱ��ͭ����ʯī���缫������ʳ��ˮ������ʣ���ⷴӦΪ2Cu+H2O
| ||
��4��ֱ���ŷź�SO2���������γ����꣬Σ����������NaOH��Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ�����
n��SO
| 91��9 | 1��1 | 1��91 | ||||
| PH��25�棩 | 8.2 | 7.2 | 6.2 |
���㣺���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ��,�Ʊ�ʵ�鷽�������
ר�⣺ʵ�������
��������1��������ѧ����ʽ��Ԫ�ػ��ϼ۱仯�������ת�ƣ�
��2��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ����ԭ���غ���ƽ��д��ѧ����ʽ����֤¯���к���FeO��Ҫ���ܺ��ø��������Һ�����������ӵĴ��ڣ�
��3���绯ѧ���Ʊ�Cu2Oʱ����������Cu2O��ͭ���ӱ���ԭ��ͭӦΪ��������������ͭ���ӣ��Բ���ͭ���ӣ�
��4��������Һ�е���غ�������غ�ȷ����Һ�и�������Ũ�ȵĹ�ϵ��
��2��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ����ԭ���غ���ƽ��д��ѧ����ʽ����֤¯���к���FeO��Ҫ���ܺ��ø��������Һ�����������ӵĴ��ڣ�
��3���绯ѧ���Ʊ�Cu2Oʱ����������Cu2O��ͭ���ӱ���ԭ��ͭӦΪ��������������ͭ���ӣ��Բ���ͭ���ӣ�
��4��������Һ�е���غ�������غ�ȷ����Һ�и�������Ũ�ȵĹ�ϵ��
���
�⣺��1��8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2��Ԫ�ػ��ϼ����ߵ�Ϊ����Ԫ��+2�۱仯Ϊ+3�ۣ���Ԫ�ػ��ϼ�-2�۱仯Ϊ+4�ۣ�Ԫ�ػ��ϼ۽��͵�ͭԪ�ػ��ϼ�+2�۱仯Ϊ0�ۣ���Ԫ�ػ��ϼ�-2�۱仯Ϊ-2�ۣ���ϵ����غ�����֪8molCuFeS2��Ӧ����ת��=��8��2+21��2��2��=100mol��
����1molCuFeS2���뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ12.5mol��
�ʴ�Ϊ��12.5��
��2��a��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ���Ӧ�Ļ�ѧ����ʽΪ��2Fe��OH��3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O��
�ʴ�Ϊ��2Fe��OH��3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O��
b����֤¯���к���FeO��Ҫ���ܺ��ø��������Һ�����������ӵĴ��ڣ�ȡ¯������ϡ�����ܽ������������Һ�Ϻ�ɫ��ʧ˵�����У������У�
�ʴ�Ϊ��ϡ���ᣬKMnO4��
��3���Ʊ�����������ͭ��Cu2O��ʱ��ͭ����ʯī���缫������ʳ��ˮ������ʣ���ⷴӦΪ2Cu+H2O
Cu2O+H2����ͭӦΪ����������ͭʧ���ӷ���������Ӧ����������ͭ���缫��ӦΪ��2Cu-2e-+H2O=Cu2O+2H+��
�ʴ�Ϊ��2Cu-2e-+H2O=Cu2O+2H+��
��4������Һ������ʱ����Һ��������Ũ�ȵ�������������Ũ�ȣ��������������Ũ�ȴ��������������Ũ�ȣ���Һ������ʱ����Һ��������Ũ�ȵ�������������Ũ�ȣ��������������Ũ�ȴ��������������Ũ�ȣ���Һ�������������������ȣ����Եõ���Һ������Ũ�ȴ�СΪ��c��Na+����c��HSO3-����c��SO32-����c��H-��=c��OH-����
�ʴ�Ϊ��c��Na+����c��HSO3-����c��SO32-����c��H-��=c��OH-����
| ||
����1molCuFeS2���뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ12.5mol��
�ʴ�Ϊ��12.5��
��2��a��Fe��OH��3��NaClO��NaOH��Ӧ�����ɸ������ƣ���Ӧ�Ļ�ѧ����ʽΪ��2Fe��OH��3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O��
�ʴ�Ϊ��2Fe��OH��3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O��
b����֤¯���к���FeO��Ҫ���ܺ��ø��������Һ�����������ӵĴ��ڣ�ȡ¯������ϡ�����ܽ������������Һ�Ϻ�ɫ��ʧ˵�����У������У�
�ʴ�Ϊ��ϡ���ᣬKMnO4��
��3���Ʊ�����������ͭ��Cu2O��ʱ��ͭ����ʯī���缫������ʳ��ˮ������ʣ���ⷴӦΪ2Cu+H2O
| ||
�ʴ�Ϊ��2Cu-2e-+H2O=Cu2O+2H+��
��4������Һ������ʱ����Һ��������Ũ�ȵ�������������Ũ�ȣ��������������Ũ�ȴ��������������Ũ�ȣ���Һ������ʱ����Һ��������Ũ�ȵ�������������Ũ�ȣ��������������Ũ�ȴ��������������Ũ�ȣ���Һ�������������������ȣ����Եõ���Һ������Ũ�ȴ�СΪ��c��Na+����c��HSO3-����c��SO32-����c��H-��=c��OH-����
�ʴ�Ϊ��c��Na+����c��HSO3-����c��SO32-����c��H-��=c��OH-����
���������⿼�������ʷ������̷����жϣ�������ԭ��Ӧ����ת�Ƽ���Ӧ�ã����ԭ���͵������Һ������Ũ�ȴ�С�ȽϷ��������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
�����Ŀ