题目内容
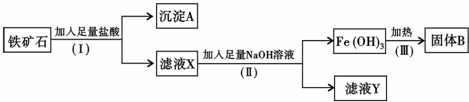
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3.操作流程如图:
查阅资料,部分阳离子以氢氧化物形式沉淀时pH如表:
(1)(I)步骤中分离溶液和沉淀的操作名称是 .
(2)沉淀A中主要含有 (填化学式).
(3)滤液Y中的阴离子除OH-、Cl-外,还有 (填离子符号).
(4)该铁矿石中常混有少量的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,为了除去滤液X中含有的Fe2+,常加入氧化剂H2O2,H2O2还原产物为水,写出该反应的离子方程式 .若要使该溶液中Fe3+完全沉淀,而Al3+不沉淀(已知Al(OH)3开始沉淀时pH为4.1),你认为pH的最佳调控范围是 .
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol?L-1时,沉淀已经完全.请利用上表中数据估算Fe(OH)2的溶度积 .
(6)金属Fe、Al用途广,Li-Al/FeS电池是一种车载电池,正极电极反应式为:2Li++FeS+2e-═Li2S+Fe;负极电极反应式为:2Li-2e-═2Li+.下列叙述正确的是 .
A.该电池的电池反应式为2Li+FeS═Li2S+Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
C.电池工作时,电子通过外电路从正极流向负极.

查阅资料,部分阳离子以氢氧化物形式沉淀时pH如表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.0 |
(2)沉淀A中主要含有
(3)滤液Y中的阴离子除OH-、Cl-外,还有
(4)该铁矿石中常混有少量的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,为了除去滤液X中含有的Fe2+,常加入氧化剂H2O2,H2O2还原产物为水,写出该反应的离子方程式
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol?L-1时,沉淀已经完全.请利用上表中数据估算Fe(OH)2的溶度积
(6)金属Fe、Al用途广,Li-Al/FeS电池是一种车载电池,正极电极反应式为:2Li++FeS+2e-═Li2S+Fe;负极电极反应式为:2Li-2e-═2Li+.下列叙述正确的是
A.该电池的电池反应式为2Li+FeS═Li2S+Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
C.电池工作时,电子通过外电路从正极流向负极.
考点:物质分离和提纯的方法和基本操作综合应用,常见化学电源的种类及其工作原理
专题:实验设计题,电化学专题
分析:铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3,依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸为沉淀A;滤液中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氯化铝全部反应生成偏铝酸钠溶液和氯化钠溶液,氢氧化铁加热分解生成氧化铁和水;
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤;
(2)依据分析判断可知A为SiO2;
(3)滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-;
(4)含有的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,加入氧化剂H2O2,把亚铁离子为铁离子,H2O2还原产物为水;使该溶液中Fe3+完全沉淀,而Al3+不沉淀结合图表数据分析判断;
(5)依据溶度积概念计算;
(6)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:Li-e-═Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,所以电池反应为:2Li+FeS═Li2S+Fe,充电时为电解池原理,阴极发生还原反应,反应式是2Li++2e-═2Li.
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤;
(2)依据分析判断可知A为SiO2;
(3)滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-;
(4)含有的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,加入氧化剂H2O2,把亚铁离子为铁离子,H2O2还原产物为水;使该溶液中Fe3+完全沉淀,而Al3+不沉淀结合图表数据分析判断;
(5)依据溶度积概念计算;
(6)Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li-Al/FeS,判断出负极材料为Li,发生反应为:Li-e-═Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,所以电池反应为:2Li+FeS═Li2S+Fe,充电时为电解池原理,阴极发生还原反应,反应式是2Li++2e-═2Li.
解答:
解:铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3,依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,二氧化硅不溶于盐酸为沉淀A;滤液中加入过量氢氧化钠溶液,氯化铁全部反应生成氢氧化铁沉淀,氢氧化铝是两性氢氧化物溶于强碱溶液,氯化铝全部反应生成偏铝酸钠溶液和氯化钠溶液,氢氧化铁加热分解生成氧化铁和水;
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤,故答案为:过滤;
(2)依据分析判断可知A为SiO2,故答案为:SiO2;
(3)滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-,故答案为:AlO2-;
(4)该铁矿石中常混有少量的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,为了除去滤液X中含有的Fe2+,常加入氧化剂H2O2,把亚铁离子为铁离子,H2O2还原产物为水,该反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O;若要使该溶液中Fe3+完全沉淀,而Al3+不沉淀(已知Al(OH)3开始沉淀时pH为4.1),你认为pH的最佳调控范围是:3.2≤pH<4.1;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;3.2≤pH<4.1;
(5)残留在溶液中的离子浓度小于1.0×10-5 mol?L-1时,沉淀已经完全.Fe(OH)2完全沉淀pH=9,c(OH-)=
=10-5mol/L,Ksp=c(Fe2+)c2(OH-)=10-5mol/L×(10-5mol/L)2=10-15mol3?L-3,故答案为:1.0×10-15 mol3?L-3;
(6)A、根据正极反应2Li++FeS+2e-═Li2S+Fe与负极反应2Li-2e-═2Li+相加可得反应的电池反应式为:2Li+FeS═Li2S+Fe,故A正确;
B、Li和Al都属于金属,所以Li-Al应该属于合金而不是化合物,因此化合价为0价,故B错误;
C、负极应该是Li失去电子而不是Al,电子负极经外电路流向正极,故C错误;
故选:A.
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称为过滤,故答案为:过滤;
(2)依据分析判断可知A为SiO2,故答案为:SiO2;
(3)滤液Y是偏铝酸钠、氯化钠溶液,溶液中的阴离子除OH-、Cl-外,还有AlO2-,故答案为:AlO2-;
(4)该铁矿石中常混有少量的FeO杂质,加入足量的盐酸后,滤液X中含有少量Fe2+,为了除去滤液X中含有的Fe2+,常加入氧化剂H2O2,把亚铁离子为铁离子,H2O2还原产物为水,该反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O;若要使该溶液中Fe3+完全沉淀,而Al3+不沉淀(已知Al(OH)3开始沉淀时pH为4.1),你认为pH的最佳调控范围是:3.2≤pH<4.1;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;3.2≤pH<4.1;
(5)残留在溶液中的离子浓度小于1.0×10-5 mol?L-1时,沉淀已经完全.Fe(OH)2完全沉淀pH=9,c(OH-)=
| 10=14 |
| 10-9 |
(6)A、根据正极反应2Li++FeS+2e-═Li2S+Fe与负极反应2Li-2e-═2Li+相加可得反应的电池反应式为:2Li+FeS═Li2S+Fe,故A正确;
B、Li和Al都属于金属,所以Li-Al应该属于合金而不是化合物,因此化合价为0价,故B错误;
C、负极应该是Li失去电子而不是Al,电子负极经外电路流向正极,故C错误;
故选:A.
点评:本题考查了铁矿石提取氧化铁的流程分析,主要考查了二氧化硅不溶于酸,氢氧化铝溶于强碱溶液,溶度积常数计算分析,原电池原理的理解应用,题目难度中等.

练习册系列答案
相关题目
 有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )
有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )| A、X元素位于ⅥA |
| B、热稳定性:B>C |
| C、C极易溶于B中,溶液呈碱性 |
| D、A和C不可能发生氧化还原反应 |
下列电离方程式错误的是( )
| A、含H2CO3的溶液:H2CO3═2H++CO32- |
| B、极少量Fe(OH)3溶于水:Fe(OH)3?Fe3++3OH- |
| C、醋酸溶液:CH3COOH??H++CH3COO- |
| D、NaHSO4溶于水:NaHSO4═Na++H++SO42- |
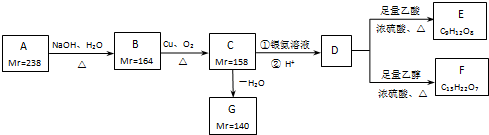
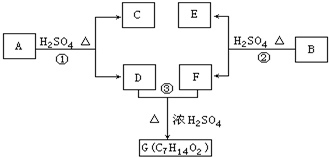 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系: