题目内容
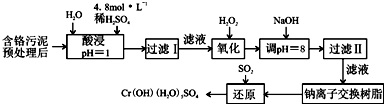
NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得.工艺流程如图:
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示.
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 .
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);加入NaOH调节pH的范围是 ,为了除去溶液中的 离子.
(3)滤液Ⅱ的主要成分是 .
(4)检验Ni2+已完全沉淀的实验方法是 .
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4?6H2O晶体;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干.

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
(1)下列措施可行,且能提高废渣浸出率的有
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是
(3)滤液Ⅱ的主要成分是
(4)检验Ni2+已完全沉淀的实验方法是
(5)操作Ⅰ的实验步骤依次为:
①
②
③蒸发浓缩、冷却结晶,过滤得NiSO4?6H2O晶体;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干.
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率从反应效率考虑分析;
(2)根据H2O2强氧化性及其除杂离子的原理分析;
(3)经过加入H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(4)检验废液中是否还含有Ni2+离子;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率从反应效率考虑分析;
(2)根据H2O2强氧化性及其除杂离子的原理分析;
(3)经过加入H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(4)检验废液中是否还含有Ni2+离子;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4.
解答:
解:废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率即提高反应速率,所以AC都可以提高反应速率,而B增大压强对反应没影响,故选:AC;
(2)因为废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后含有二价铁离子、三价铁离子、三价铬离子杂质,所以加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;[5.6,8.4);Fe3+、Cr3+;
(3)经过加入H2O2、NaOH后可除去Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,故答案为:Na2SO4、NiSO4;
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成,故答案为:静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4,所以操作步骤为:①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀H2SO4溶液,直至恰好完全溶解,
故答案为:过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;向沉淀中加稀的H2SO4溶液,直至恰好完全溶解.
(1)能提高废渣浸出率即提高反应速率,所以AC都可以提高反应速率,而B增大压强对反应没影响,故选:AC;
(2)因为废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后含有二价铁离子、三价铁离子、三价铬离子杂质,所以加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;[5.6,8.4);Fe3+、Cr3+;
(3)经过加入H2O2、NaOH后可除去Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,故答案为:Na2SO4、NiSO4;
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成,故答案为:静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4,所以操作步骤为:①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀H2SO4溶液,直至恰好完全溶解,
故答案为:过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;向沉淀中加稀的H2SO4溶液,直至恰好完全溶解.
点评:本题考查物质的分离提纯的实验方案的设计,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
以Al2O3为原料制取氢氧化铝,最好的方法是( )
| A、将Al2O3溶于水 |
| B、将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液 |
| C、将Al2O3先溶于盐酸中,之后滴加氨水 |
| D、将Al2O3先溶于NaOH溶液中,之后再滴加盐酸 |
 有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )
有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子.下列说法中不正确的是( )| A、X元素位于ⅥA |
| B、热稳定性:B>C |
| C、C极易溶于B中,溶液呈碱性 |
| D、A和C不可能发生氧化还原反应 |
下列解释事实的离子方程式正确的是( )
| A、金属铝溶于氢氧化钠溶液:Al+2OH-+2H2O=[Al(OH)4]-+H2↑ |
| B、过量铁溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
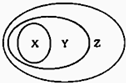 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )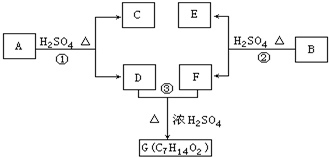 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系: