题目内容
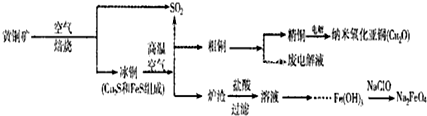
治理环境污染刻不容缓,建设美丽中国是十八大的奋斗目标.2012年底锂电池总产量超过35亿只,对不可再生的金属资源的消耗是相当大的.因此锂电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如下:

(1)根据上述工艺流程图得出:可回收到的产物除了有Li2CO3,还有 、 ;
(2)锂电池使用广泛的主要原因是 ;
(3)废旧电池可能由于放电不完全而残留单质锂,为了安全生产,对拆解环境的要求是 ;
(4)碱浸时主要反应的化学方程式为 ;
(5)最后一步过滤应趁热过滤,原因是 .

(1)根据上述工艺流程图得出:可回收到的产物除了有Li2CO3,还有
(2)锂电池使用广泛的主要原因是
(3)废旧电池可能由于放电不完全而残留单质锂,为了安全生产,对拆解环境的要求是
(4)碱浸时主要反应的化学方程式为
(5)最后一步过滤应趁热过滤,原因是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据锂电池的优点来回答;
(3)从金属锂的化学性质分析,锂为活泼金属;
(4)根据铝能和碱反应来写方程式;
(5)根据Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤.
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据锂电池的优点来回答;
(3)从金属锂的化学性质分析,锂为活泼金属;
(4)根据铝能和碱反应来写方程式;
(5)根据Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤.
解答:
解:题干工艺流程为:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)工艺流程的最终产物为:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3;CoSO4;
(2)单位质量的金属锂放出的电量很大,所以锂电池使用广泛,故答案为:单位质量的金属锂放出的电量很大;
(3)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(4)铝能与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,防止析出硫酸钠晶体,故答案为:防止析出硫酸钠晶体.
(1)工艺流程的最终产物为:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3;CoSO4;
(2)单位质量的金属锂放出的电量很大,所以锂电池使用广泛,故答案为:单位质量的金属锂放出的电量很大;
(3)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(4)铝能与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,防止析出硫酸钠晶体,故答案为:防止析出硫酸钠晶体.
点评:本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,难度中等.

练习册系列答案
相关题目
下列物质中,属于能导电的电解质的是( )
| A、无水酒精 |
| B、熔融的氯化钠 |
| C、纯铝导线 |
| D、氢氧化钠晶体 |
下列电离方程式错误的是( )
| A、含H2CO3的溶液:H2CO3═2H++CO32- |
| B、极少量Fe(OH)3溶于水:Fe(OH)3?Fe3++3OH- |
| C、醋酸溶液:CH3COOH??H++CH3COO- |
| D、NaHSO4溶于水:NaHSO4═Na++H++SO42- |
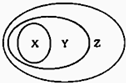 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
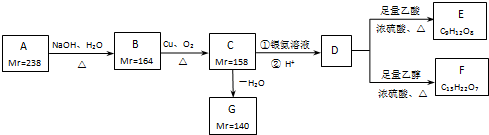
 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系: