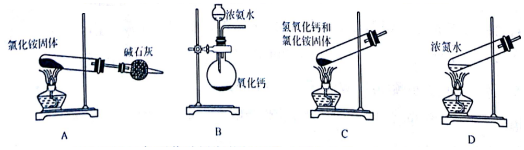
题目内容
7.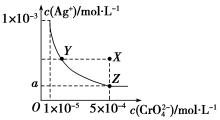 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.(1)向饱和Ag2CrO4溶液中加入固体K2CrO4不能(填“能”或“不能”)使溶液由Y点变为X点
(2)图中a=$\sqrt{2}$×10-4.
分析 (1)在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
(2)溶度积常数不变,依据溶液中Z点时离子浓度计算.
解答 解:(1)在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,
故答案为:不能;
(2)依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)=1×10-11,Z点时c(CrO42-)=5×10-4,则c(Ag+)2=2×10-8,所以a=$\sqrt{2}$×10-4,
故答案为:$\sqrt{2}$×10-4.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,明确难溶物溶度积的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
17.某化学反应 3A?2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
18.下列离子方程式正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
15.一定温度下,反应2NO2(g)?N2O4(g)△H<0,在密闭容器中达到平衡状态. 下列说法中正确的是( )
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
2.锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如图(部分条件未给出).
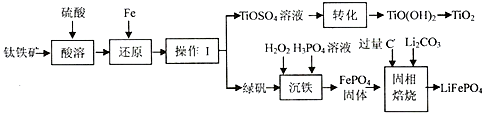
(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
则操作I 的名称为蒸发浓缩、冷却结晶、过滤.
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.

(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.
12. 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
下列说法正确的是( )
 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.下列说法正确的是( )
| A. | 丙也可由W、Y组成的某种化合物与K直接反应制得 | |
| B. | K、L、M 中沸点最高的是M | |
| C. | 原子半径:W<X<Y | |
| D. | 元素的非金属性:Z>Y>X |
16.短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的$\frac{2}{3}$,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价,下列说法正确的是( )
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
16.下列实验操作正确的是( )
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.