题目内容
某固体化合物A,按如图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀W很快变为灰绿色,最后变为红褐色
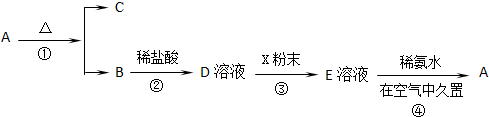
(1)物质A的化学式为 ;物质B的俗名是 ,
(2)按要求写出下列转化过程的反应方程式:
A→B+C: ;W不稳定,原因是: ;
(3)有一瓶存放时间较长的E溶液,某学生怀疑其有部分因氧化而变质,请你设计1个检验它是否变质的实验方案: ; 如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质? .

(1)物质A的化学式为
(2)按要求写出下列转化过程的反应方程式:
A→B+C:
(3)有一瓶存放时间较长的E溶液,某学生怀疑其有部分因氧化而变质,请你设计1个检验它是否变质的实验方案:
考点:无机物的推断
专题:推断题
分析:固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色,B到D时加入的盐酸,推断E为FeCl2,A为Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,结合对应物质的性质以及题目要求解答该题.
解答:
解:固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色,B到D时加入的盐酸,推断E为FeCl2,A为Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,
(1)由以上分析可知A为Fe(OH)3,B为Fe2O3,俗称铁红,故答案为:Fe(OH)3;铁红;
(2)氢氧化铁分解生成氧化铁和水的反应,反应为2Fe(OH)3
Fe2O3+3H2O,白色沉淀W为Fe(OH)2,具有还原性,易被空气中的氧气氧化而生成Fe(OH)3,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:2Fe(OH)3
Fe2O3+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)若E变质,亚铁离子会被氧化成铁离子,可使用硫氰化钾溶液检验,方法为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;如果变质,硫酸亚铁溶液中存在硫酸铁,为了不引进新的杂质,可以向硫酸亚铁溶液中加入少量的铁粉,将铁离子还原成亚铁离子,
故答案为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉.
(1)由以上分析可知A为Fe(OH)3,B为Fe2O3,俗称铁红,故答案为:Fe(OH)3;铁红;
(2)氢氧化铁分解生成氧化铁和水的反应,反应为2Fe(OH)3
| ||
故答案为:2Fe(OH)3
| ||
(3)若E变质,亚铁离子会被氧化成铁离子,可使用硫氰化钾溶液检验,方法为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;如果变质,硫酸亚铁溶液中存在硫酸铁,为了不引进新的杂质,可以向硫酸亚铁溶液中加入少量的铁粉,将铁离子还原成亚铁离子,
故答案为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉.
点评:本题考查无机物推断,涉及铁及其化合物性质,难度不大,熟练掌握元素化合物性质即可解答,注意把握实验方案的设计和物质的检验.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
石灰石是一种化工原料,可以通过反应生成一系列物质,如图.
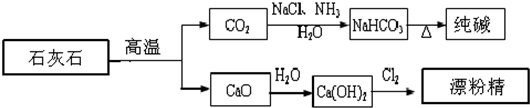
下列说法正确的是( )

下列说法正确的是( )
| A、漂粉精是混合物,主要成分是氯化钙 |
| B、图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2 |
| C、纯碱属于碱,俗名苏打 |
| D、制取纯碱和漂粉精所涉及的反应都是非氧化还原反应 |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
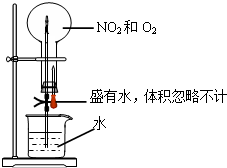 用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )
用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )A、
| ||
B、
| ||
C、
| ||
| D、无法计算 |
下列溶液中氯离子浓度最大的是( )
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0×10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7 mol/L的KI溶液混合,下列说法正确的是(溶液体积变化忽略不计)( )
| A、不能确定有无AgI沉淀生成 |
| B、没有AgI沉淀生成 |
| C、有KNO3晶体析出 |
| D、有AgI沉淀生成 |
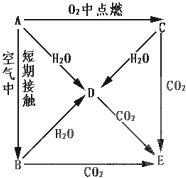 A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.