题目内容
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为( )
| A、9.3×10-5 mol/L |
| B、9.7×10-9 mol2/L2 |
| C、7.6×10-17 mol4/L4 |
| D、8.7×10-9 mol2/L2 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:CaCO3属于强电解质,在水溶液中完全电离,根据Ksp的计算公式计算.
解答:
解:CaCO3属于强电解质,在水溶液中完全电离,CaCO3饱和溶液中c(Ca2+)=c(CO32-)=9.327×10-5 mol/L,Ksp=9.327×10-5 mol/L×9.327×10-5 mol/L=8.7×10-9 mol2/L2.故选:D.
点评:本题考查了CaCO3的Ksp的计算,注意CaCO3是强电解质,在水溶液中完全电离.

练习册系列答案
相关题目
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
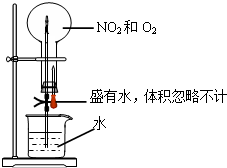 用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )
用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )A、
| ||
B、
| ||
C、
| ||
| D、无法计算 |
下列溶液中氯离子浓度最大的是( )
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
下列说法正确的是( )
| A、难溶电解质的溶度积越小,溶解度越大 |
| B、可以通过沉淀反应使杂质离子完全沉淀 |
| C、难溶电解质的溶解达到平衡后就静止不动了 |
| D、一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0×10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7 mol/L的KI溶液混合,下列说法正确的是(溶液体积变化忽略不计)( )
| A、不能确定有无AgI沉淀生成 |
| B、没有AgI沉淀生成 |
| C、有KNO3晶体析出 |
| D、有AgI沉淀生成 |
电解CuSO4溶液时,要求达到三点(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是( )
| A、纯铜作阳极,含Zn和Ag的铜合金作阴极 |
| B、含Zn和Ag的铜合金作阳极,纯铜作阴极 |
| C、用纯铁作阳极,纯铜作阴极 |
| D、用石墨作阳极,纯铜作阴极 |
下列叙述中正确的是( )
| A、在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热 |
| B、热化学方程式中,各物质前的化学计量数不表示分子个数 |
| C、在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
| D、如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热 |