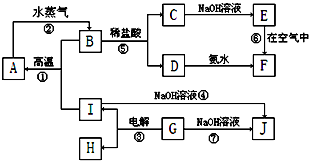
题目内容
16.以下是元素周期表的一部分,根据图示回答下列问题: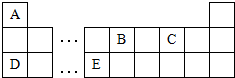
(1)将16.25gFeCl3投入足量A2C2溶液中,产生大量气泡,反应完全后,FeCl3的质量为16.25g.
(2)1.3gB2A2气体完全燃烧,恢复至室温,放出65kJ热量,写出代表B2A2燃烧热的热化学反应方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol.
(3)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
分析 由图可知,A为H,B为C,C为O,D为Na,E为Al,
(1)FeCl3在H2O2分解中作催化剂;
(2)1.3gC2H2的物质的量为$\frac{1.3g}{26g/mol}$=0.05mol,完全燃烧,恢复至室温,放出65kJ热量,则1molC2H2完全燃烧,恢复至室温,放出热量为$\frac{65kJ}{0.05}$=1300kJ,以此书写热化学方程式;
(3)NaOH与氢氧化铝反应生成偏铝酸钠和水.
解答 解:由图可知,A为H,B为C,C为O,D为Na,E为Al,
(1)FeCl3在H2O2分解中作催化剂,则反应完全后,FeCl3的质量为16.25g,故答案为:16.25;
(2)1.3gC2H2的物质的量为$\frac{1.3g}{26g/mol}$=0.05mol,完全燃烧,恢复至室温,放出65kJ热量,则1molC2H2完全燃烧,恢复至室温,放出热量为$\frac{65kJ}{0.05}$=1300kJ,则燃烧热的热化学方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol;
(3)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、化学反应原理为解答的关键,侧重分析与应用能力的考查,注意热化学方程式的书写及催化剂在反应前后的质量不变,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列说法中错误的是( )
| A. | 温度越高,酶的催化活性越强 | |
| B. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了显色反应 | |
| C. | 用灼烧的方法可以鉴别毛织物和棉织物 | |
| D. | 在豆浆中加入少量的石膏,能使豆浆凝结为豆腐 |
4.下列离子方程式正确的是( )
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 金属钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 澄清石灰中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
1.下列说法正确的是( )
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 可以用澄清石灰水鉴别CO2和SO2 | |
| C. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
2.短周期主族元素X、Y、Z、W、R的原子序数依次增大,其中前四种元素原子的最外层电子数之和为14.X是周期表中原子半径最小的元素,Z是短周期中金属性最强的元素,Y与W原子序数相差8.下列说法不正确的是( )
| A. | 原子半径:X<W<Z | |
| B. | 最高价氧化物对应水化物的酸性:W>R | |
| C. | 简单气态氢化物的热稳定性:Y>W | |
| D. | Y在周期表中的位置为第二周期ⅥA族 |
20.分子式为 C5H8O2的有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有( )
| A. | 8 种 | B. | 10 种 | C. | 11 种 | D. | 12 种 |