题目内容
1.下列说法正确的是( )| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 可以用澄清石灰水鉴别CO2和SO2 | |
| C. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
分析 A.使有毒的CO和NO反应生成N2和CO2,减少污染物的排放;
B.CO2和SO2均与石灰水反应生成白色沉淀;
C.S与氧气反应生成二氧化硫,与氧气是否过量无关;
D.酸雨的pH<5.6.
解答 解:A.使有毒的CO和NO反应生成N2和CO2,减少污染物的排放,则提倡在汽车的排气管上装有“催化转化器”,故A正确;
B.CO2和SO2均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故B错误;
C.S与氧气反应生成二氧化硫,与氧气是否过量无关,二氧化硫发生催化氧化生成三氧化硫,故C错误;
D.酸雨的pH<5.6,与排放的二氧化硫有关,故D错误;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应、环境保护与化学的关系等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
12.下列反应的离子方程式书写正确的是( )
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
4.苄基(C6H5CH2-)、-OH、-CHO、-COOH四种基团,它们之间两两组合,所形成的有机物有( )
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
5.下列各物质中,能发生加成反应的是( )
| A. | 天然气 | B. | 苯 | C. | 沼气 | D. | 瓦斯 |

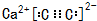 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)