题目内容
13.由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是( )| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
分析 碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,据此分析解答.
解答 解:碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,
A.H2SO3>HCO3-,符合强酸制弱酸,故A合理;
B.H2CO3可与SO32-反应得到HSO3-,故B不合理;
C.H2CO3与HSO3-能共存,故C合理;
D.HCO3-与HSO3-能共存,故D合理;
故选B.
点评 题目考查了离子反应发生的条件和弱电解质电离程度大小,明确电离平衡常数与酸性强弱关系、强酸制取弱酸原理是解本题关键,知道哪些物质之间能反应,哪些微粒之间能共存,为易错题.

练习册系列答案
相关题目
4.下列物质中,体积为22.4升的是( )
| A. | 25℃时18 g水 | |
| B. | 标准状况下含6.02×1023个原子的Cl2 | |
| C. | 标准状况下1 mol氨气 | |
| D. | 常温常压下44 g二氧化碳 |
1.用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++CO32-═H2O+CO2↑的反应个数有
( )
( )
| A. | 4个 | B. | 5个 | C. | 8个 | D. | 12个 |
18.在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10 mol•L-1.下列有关该溶液的叙述正确的是( )
| A. | 该溶液一定呈酸性 | |
| B. | 该溶液中c(H+)可能等于10-5 mol•L-1 | |
| C. | 该溶液的pH可能为4也可能为10 | |
| D. | 该溶液有可能呈中性 |
2.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)S原子结构示意图为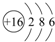 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;
(2)Na和Mg金属性较强的元素是Na(填元素符号),写出能证明这一结论的一个实验事实Na与水反应剧烈,Mg与水反应现象不明显;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式),气态氢化物最稳定的是HCl(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)Si是带来人类文明的重要元素之一,其氧化物是共价(填“离子”“共价”)化合物,常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;(2)Na和Mg金属性较强的元素是Na(填元素符号),写出能证明这一结论的一个实验事实Na与水反应剧烈,Mg与水反应现象不明显;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式),气态氢化物最稳定的是HCl(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)Si是带来人类文明的重要元素之一,其氧化物是共价(填“离子”“共价”)化合物,常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
3.下列反应中,熵显著增加的反应是( )
| A. | CO+2H2═CH3OH | B. | CaCO3+2HCl═CaCl2+CO2↑+H2O | ||
| C. | 2H2+O2═2H2O | D. | CaO+H2O═Ca(OH)2 |
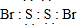 ;
; 试回答下列问题:
试回答下列问题: