题目内容
5.无机化合物A含有三种元素,其中一种为Na.A的摩尔质量为39g•mol-1,一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况下)气体C,已知气体C极易溶于水,且得到的溶液显碱性.电解熔融B可生成金属Na和氯气.请回答下列问题:(1)A的化学式是NaNH2.
(2)化合物A与NH4Cl反应的化学方程式为NaNH2+NH4Cl=2NH3↑+NaCl.
(3)某同学通过查阅资料得知物质A的部分性质如下:
Ⅰ.工业上可用金属Na与液态C在催化剂条件下来制备物质A.
Ⅱ.物质A遇水强烈水解,释放出气体C.
Ⅲ.A与Na2O反应可生成D、NaOH和气体C.
①Ⅰ中发生反应的基本反应类型是2Na+2NH3=2NaNH2+H2↑.
②物质A遇水强烈水解的化学方程式为NaNH2+H2O=NaOH+NH3↑.
③D的摩尔质量为65g•mol-1,加热D使其完全分解,生成两种单质.则D中所含的化学键有离子键、共价键.
分析 无机化合物A含有三种元素,其中一种为Na.A的摩尔质量为39g•mol-1,一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况下)气体C,已知气体C极易溶于水,且得到的溶液显碱性,证明C为NH3,物质的量n(NH3)=$\frac{4.48L}{22.4L/mol}$=0.2mol,电解熔融B可生成金属Na和氯气,说明B为NaCl,A是碱性物质,若是氢氧化钠,摩尔质量为40g/mol,且只能生成0.1molNH3,反应生成的是0.2molNH3,则说明A中含氮原子,依据摩尔质量为39g/mol,可知含钠、氮,39-23-14=2,则应含2个H,所以判断A为NaNH2,
(1)分析可知A为NaNH2;
(2)化合物A与NH4Cl反应生成氨气和氯化钠,结合原子守恒配平书写化学方程式;
(3)①用金属Na与液态C在催化剂条件下来制备物质A是氨气和钠反应生成NaNH2和氢气;
②物质A遇水强烈水解反应生成氨气和氢氧化钠;
③A是NaNH2与Na2O反应可生成D、NaOH和气体C为NH3,元素守恒分析D中只可能含钠元素、氮元素、氧元素、氢元素,D的摩尔质量为65g•mol-1,加热D使其完全分解,生成两种单质,说明D中含两种元素,则推断D为氮元素和钠元素组成,化学式NaN3;
解答 解:无机化合物A含有三种元素,其中一种为Na.A的摩尔质量为39g•mol-1,一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况下)气体C,已知气体C极易溶于水,且得到的溶液显碱性,证明C为NH3,物质的量n(NH3)=$\frac{4.48L}{22.4L/mol}$=0.2mol,电解熔融B可生成金属Na和氯气,说明B为NaCl,A是碱性物质,若是氢氧化钠,摩尔质量为40g/mol,且只能生成0.1molNH3,反应生成的是0.2molNH3,则说明A中含氮原子,依据摩尔质量为39g/mol,可知含钠、氮,39-23-14=2,则应含2个H,所以判断A为NaNH2,
(1)分析可知A为NaNH2,
故答案为:NaNH2;
(2)化合物A与NH4Cl反应生成氨气和氯化钠,结合原子守恒配平书写化学方程式为:NaNH2+NH4Cl=2NH3↑+NaCl,
故答案为:NaNH2+NH4Cl=2NH3↑+NaCl;
(3)①用金属Na与液态C在催化剂条件下来制备物质A是氨气和钠反应生成NaNH2和氢气,反应的化学方程式为:2Na+2NH3=2NaNH2+H2↑,
故答案为:2Na+2NH3=2NaNH2+H2↑;
②物质A遇水强烈水解反应生成氨气和氢氧化钠,反应的化学方程式为:NaNH2+H2O=NaOH+NH3↑,
故答案为:NaNH2+H2O=NaOH+NH3↑;
③A是NaNH2与Na2O反应可生成D、NaOH和气体C为NH3,元素守恒分析D中只可能含钠元素、氮元素、氧元素、氢元素,D的摩尔质量为65g•mol-1,加热D使其完全分解,生成两种单质,说明D中含两种元素,则推断D为氮元素和钠元素组成,化学式NaN3,含有的化学键为离子键、共价键,
故答案为:离子键、共价键;
点评 本题考查了碱金属性质的综合应用,信息分析和条件应用是解题突破点,物质组成和性质的类推是解题关键,题目难度中等.

| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )| A. | 能发生加成反应、氧化反应和取代反应 | |
| B. | 遇 FeC13溶液能发生显色反应 | |
| C. | 分子中所有的原子可能共平面 | |
| D. | lmolEGC与4mo1NaOH恰好完全反应 |
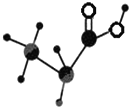 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )| A. | 结构简式是C3H6O2 | B. | 不能和NaOH溶液反应 | ||
| C. | 官能团是羟基 | D. | 能发生取代反应 |

