题目内容
3.SOBr2是一种常用的吸水剂.SOBr2不太稳定,加热时会发生分解:4SOBr2$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+3Br2+A.(1)SOBr2是共价(填“共价”或“离子”)化合物;
(2)A的电子式为
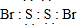 ;
;(3)KBr在液态SO2中能生成Br2、A和K2SO4,其反应的化学方程式为4KBr+4SO2=Br2+S2Br2+2K2SO4.
分析 (1)含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
(2)根据元素守恒、原子守恒知,A为S2Br2,每个Br原子和每个S原子形成一对共用电子对,该分子中所有原子都达到8电子稳定结构;
(3)根据反应物和生成物书写化学方程式.
解答 解:(1)含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,该分子中只含共价键,为共价化合物,故答案为:共价;
(2)根据元素守恒、原子守恒知,A为S2Br2,每个Br原子和每个S原子形成一对共用电子对,该分子中所有原子都达到8电子稳定结构,其电子式为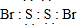 ,故答案为:
,故答案为: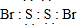 ;
;
(3)根据反应物和生成物书写化学方程式,该反应方程式为4KBr+4SO2=Br2+S2Br2+2K2SO4,故答案为:4KBr+4SO2=Br2+S2Br2+2K2SO4.
点评 本题考查化合物类型判断、电子式的书写、化学方程式书写等知识点,为高频考点,侧重考查学生分析判断及获取信息解答问题能力,难点是A电子式的书写,根据每个原子都达到8电子稳定结构正确确定元素位置,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
11.常温下,下列各组离子在指定溶液中一定能大题共存的是( )
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
18.对于反应2KMnO4$\stackrel{△}{→}$K2MnO4+MnO2+O2↑,下列说法错误的是( )
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
8.把0.01mol/LHAc溶液和0.02mol/LNaOH溶液以等体积混和充分反应后,加热蒸干,灼烧,最终残留固体为( )
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
15.下列实验操作正确的是( )
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
12.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)写出BA3的电子式: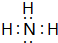 .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个取向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为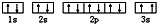 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)比较B和D的电负性N>P(填元素符号)
(5)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(6)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
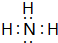 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个取向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
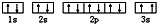 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)比较B和D的电负性N>P(填元素符号)
(5)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(6)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
13.由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是( )
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析: .
.