题目内容
2.下列热化学方程式正确的是(△H的绝对值均正确)( )| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=571.6kJ•mol-1(反应热) |
分析 A.燃烧热中生成稳定氧化物,H2O(g)不稳定;
B.中和反应为放热反应;
C.燃烧为放热反应;
D.氢气燃烧为放热反应,焓变为负值.
解答 解:A.燃烧热中生成稳定氧化物,H2O(g)不稳定,1molC2H5OH(l)生成H2O(l)、CO2(g)时能量变化为燃烧热,故A错误;
B.中和反应为放热反应,应为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,故B错误;
C.S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热),书写合理,故C正确;
D.氢气燃烧为放热反应,应为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热、中和热、反应热的关系为解答的关键,侧重分析与计算能力的考查,注意基本概念及热化学方程式书写,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
10.碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
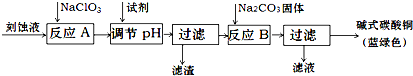
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..
7.处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体.已知:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
11.已知反应:A(g)+4B(s)=2C(g)+D(g)△H<0.则该反应( )
| A. | 能自发进行 | B. | 不能自发进行 | ||
| C. | 可能自发进行 | D. | 在加热条件下才能自发进行 |
 利用所学化学知识解答问题:
利用所学化学知识解答问题: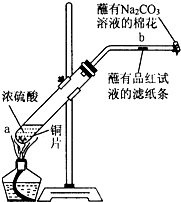 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题: