题目内容
如图为某工厂处理含Fe3+、Cu2+、Ag+废水的流程图:
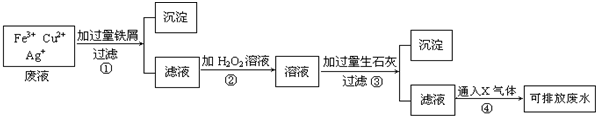
据图回答下列问题:
(1)操作①中发生反应的离子方程式为 .
(2)操作②中H2O2起了 (填“氧化”或“还原”)的作用.
(3)操作③中产生的沉淀为 (填化学式).
(4)操作④中通入的X气体为 (填化学式).

据图回答下列问题:
(1)操作①中发生反应的离子方程式为
(2)操作②中H2O2起了
(3)操作③中产生的沉淀为
(4)操作④中通入的X气体为
考点:金属的回收与环境、资源保护
专题:几种重要的金属及其化合物
分析:(1)操作①加入的过量的铁屑,由于铁的化学性质比铜、银都活泼,因此可以把金属铜、银从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,据此回答即可;
(2)根据Fe2+能被过氧化氢生成Fe3+,据此判断双氧水的作用;
(3)根据滤液中Fe2+能被过氧化氢生成Fe3+,加入双氧水后的溶液中含有的金属阳离子为Fe3+,加入强碱溶液后生成氢氧化铁沉,据此解答即可;
(4)生石灰溶于水生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,可以沉降下来,据此解答即可.
(2)根据Fe2+能被过氧化氢生成Fe3+,据此判断双氧水的作用;
(3)根据滤液中Fe2+能被过氧化氢生成Fe3+,加入双氧水后的溶液中含有的金属阳离子为Fe3+,加入强碱溶液后生成氢氧化铁沉,据此解答即可;
(4)生石灰溶于水生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,可以沉降下来,据此解答即可.
解答:
解:(1)废液中含有Fe3+、Cu2+、Ag+三种金属离子,加入过量的铁粉后,铜离子、银离子被还原成金属铜、银,Fe3+被还原为Fe2+,故答案为:Cu2++Fe=Cu+Fe2+、2Ag++Fe=2Ag+Fe2+、2Fe3++Fe=3Fe2+;
(2)Fe2+能被过氧化氢生成Fe3+,故H2O2起了氧化剂的作用,故答案为:氧化剂;
(3)滤液中含有亚铁离子,加入双氧水后溶液中亚铁离子氧化成铁离子,铁离子与氢氧根离子反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,故答案为:Fe(OH)3;
(4)生石灰与水反应生成氢氧化钙,氢氧化钙可以与二氧化碳反应生成碳酸钙沉淀,故通入的气体X为二氧化碳,故答案为CO2.
(2)Fe2+能被过氧化氢生成Fe3+,故H2O2起了氧化剂的作用,故答案为:氧化剂;
(3)滤液中含有亚铁离子,加入双氧水后溶液中亚铁离子氧化成铁离子,铁离子与氢氧根离子反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,故答案为:Fe(OH)3;
(4)生石灰与水反应生成氢氧化钙,氢氧化钙可以与二氧化碳反应生成碳酸钙沉淀,故通入的气体X为二氧化碳,故答案为CO2.
点评:本题考查了金属的回收与环境保护,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
| A、此时水的离子积KW=1×10-12 |
| B、水电离出的c(H+)=1×10-12mol.L-1), |
| C、水的电离程度随温度升高而增大 |
| D、c(Na+)=c(SO42-) |
关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
下列各项描述正确的是( )
| A、Fe(OH)3胶体有较强的吸附作用,是因为胶粒有较大的表面积 |
| B、白磷熔化、干冰汽化、SiO2熔化、AlCl3升华都是克服分子间作用力 |
| C、液晶是一种介于晶体和液体之间的中间态物质,分子较小,在信息技术中作用较大 |
| D、电解质熔融时一定能导电,因为破坏了化学键产生自由移动的离子 |
下列说法正确的是( )
| A、35Cl和37Cl互为同素异形体 | ||||
| B、O2和O3是氧元素的两种同位素 | ||||
| C、35Cl和37Cl中35、37表示的是质量数 | ||||
D、1
|
 某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离. 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)