题目内容
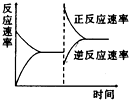
下列关于化学反应限度的说法中正确的是( )
| A、任何一个化学反应都能达到一个化学平衡状态 |
| B、当可逆反应在一定条件下达到最大限度是,正反应速率和逆反应速率相等 |
| C、平衡状态是一种静止的状态 |
| D、化学反应的限度不可能通过改变外界条件而改变 |
考点:化学平衡建立的过程
专题:
分析:A、只有可逆反应才能建立化学平衡状态;
B、当达到化学反应限度时,反应物的浓度和生成物的浓度不再改变,此时正逆反应速率相等;
C、化学平衡为动态平衡;
D、当外界条件发生改变,平衡发生移动,化学反应限度变化.
B、当达到化学反应限度时,反应物的浓度和生成物的浓度不再改变,此时正逆反应速率相等;
C、化学平衡为动态平衡;
D、当外界条件发生改变,平衡发生移动,化学反应限度变化.
解答:
解:A、只有可逆反应才能建立化学平衡状态,故A错误;
B、当达到化学反应限度时,反应物的浓度和生成物的浓度不再改变,此时正逆反应速率相等,故B正确;
C、化学平衡为动态平衡,在平衡状态,正逆反应速率相等,但不为0,不是一种静止的状态,故C错误;
D、当外界条件发生改变,平衡发生移动,化学反应限度变化,故D错误.
故选:B.
B、当达到化学反应限度时,反应物的浓度和生成物的浓度不再改变,此时正逆反应速率相等,故B正确;
C、化学平衡为动态平衡,在平衡状态,正逆反应速率相等,但不为0,不是一种静止的状态,故C错误;
D、当外界条件发生改变,平衡发生移动,化学反应限度变化,故D错误.
故选:B.
点评:本题考查化学反应限度、反应限度的影响因素,是对学生基础知识的考查,较简单,选项B是解答中的易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、NaHSO3和NaHCO3的中性混合溶液中:c(Na+)=c(HSO3-)+2c(SO32-)+c(HCO3-)+2c(CO32-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<②<③ |
| D、等体积物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
下列说法不正确的是( )
| A、硅单质可用于光纤通讯 |
| B、由SiO2制取硅酸,可先使SiO2与NaOH溶液反应,再通入CO2 |
| C、青石棉[Na2Fe5Si8O22(OH)2]的化学组成可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O |
| D、Na2SiO3可用于制备木材防火剂 |
 如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时减小生成物浓度 |
| D、增大反应物浓度,同时使用催化剂 |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、银氨溶液:H+、Na+、NO3-、Cl- |
| B、使甲基橙变红色的溶液:Mg 2+、K+、Cl-、I- |
| C、空气:C2H2、CO2、SO2、NO |
| D、高锰酸钾溶液:H+、Na+、SO42-、NO2 |
下列说法正确的是( )
| A、氢氧燃料电池的能量转换形式之一为化学能转化为电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D、催化剂通过降低化学反应的焓变加快化学反应速率 |
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
| A、此时水的离子积KW=1×10-12 |
| B、水电离出的c(H+)=1×10-12mol.L-1), |
| C、水的电离程度随温度升高而增大 |
| D、c(Na+)=c(SO42-) |
关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )