题目内容
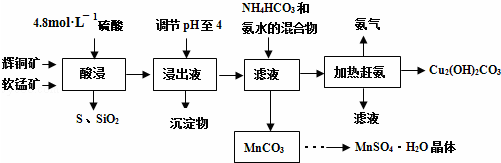
12.硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、遇酸均易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图1:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O.
④再经过滤、洗涤、干燥,得到所需的产品.
(1)写出仪器A的名称蒸馏烧瓶,步骤④中洗涤时,为了减少产物的损失用的试剂可以是乙醇;
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因S2O32-+2H+=S↓+SO2↑+H2O;
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)最后得到的产品中可能含有Na2SO4杂质.请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(5)测定产品纯度准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L-1碘的标准溶液滴定.反应原理为2S2O32-+I2═S4O62-+2I-.滴定终点的现象为:滴入最后一滴标准液时,溶液由无色变为蓝色,且半分钟内不再褪色,
滴定起始和终点的液面位置如图2:则消耗碘的标准溶液体积为16.00 mL,产品的纯度为79.36%.
分析 (1)A名称是蒸馏烧瓶;产品易溶于水难溶于乙醇;
(2)硫代硫酸钠遇酸反应生成硫、二氧化硫和水;
(3)SO2、Na2S和Na2CO3反应生成Na2S2O3,结合质量守恒确定产物并配平;
(4)加入盐酸,Na2S2O3反应生成S沉淀,静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(5)淀粉遇碘变蓝色,其它物质遇碘不变蓝色;消耗碘的标准溶液体积=(18.50-2.50)mL=16.00mL,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度.
解答 解:(1)根据仪器A的结构特点知A的名称为蒸馏烧瓶;产品易溶于水,难溶于乙醇,步骤 ④中洗涤时,为了减少产物的损失用的试剂可以是乙醇;
故答案为:蒸馏烧瓶;乙醇;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,所以产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
故答案为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(5)淀粉遇碘变蓝色,其它物质遇碘不变蓝色,所以滴定终点现象是:滴入最后一滴标准液时,溶液由无色变为蓝色,且半分钟内不再褪色;
消耗碘的标准溶液体积=(18.50-2.50)mL=16.00mL,n(I2)=0.100 0mol•L-1×0.0016L=1.6×10-4mol,根据2S2O32-+I2═S4O62-+2I-可知知n(Na2S2O3•5H2O)=3.2×10-4mol,m(Na2S2O3•5H2O)=0.7936g,产品的纯度为,其纯度=$\frac{0.7936g}{1.00g}$×100%=79.36%;
故答案为:滴入最后一滴标准液时,溶液由无色变为蓝色,且半分钟内不再褪色;16.00;79.36%.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、实验分析、评价及计算能力,明确实验原理、实验方法、元素化合物性质是解本题关键,注意(5)题碘溶液体积书写方式(保留小数点后2位),题目难度不大.

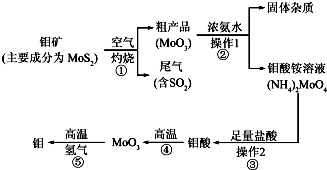
(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇.
(6)该实验生成的乙酸正丁酯的产率是65%.
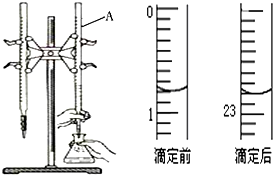 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
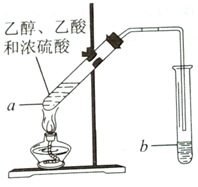 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.