题目内容
11.下列反应的离子方程式中,书写正确的是( )| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
分析 A.Fe和稀硫酸反应生成可溶性的硫酸亚铁和氢气;
B.氧化铝是氧化物,要写化学式;
C.漏写氢离子和氢氧根离子生成水的离子反应方程式;
D.电荷不守恒、转移电子不守恒.
解答 解:A.Fe和稀硫酸反应生成可溶性的硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑,故A正确;
B.氧化铝是氧化物,要写化学式,离子方程式为Al2O3+6H+=3H2O+2Al 3+,故B错误;
C.漏写氢离子和氢氧根离子生成水的离子反应方程式,离子方程式为2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故C错误;
D.电荷不守恒、转移电子不守恒,离子方程式为Cu+2Ag+═2Ag+Cu2+,故D错误;
故选A.
点评 本题考查离子方程式书写,为高频考点,侧重考查学生离子方程式书写方法的掌握和灵活运用,要遵循客观事实、原子守恒、电荷守恒、转移电子守恒,知道哪些物质写离子哪些写化学式,易错选项是C,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.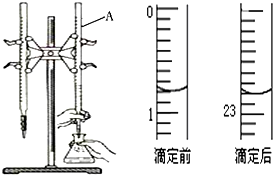 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
2.下列行为中,符合安全要求的是( )
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 28g乙烯与丙烯的混合气体中含有双键数目为NA | |
| B. | 标准状况下,22.4L甘油中含有羟基的数目为3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与S2-数目之和为0.1 NA | |
| D. | 0.2molCl2与0.1molCH4充分反应,生成HCl分子数为0.2 NA |
6.下列现象或应用中,不能用胶体知识解释的是( )
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
16.属于短周期元素的是( )
| A. | K | B. | Ca | C. | I | D. | Cl |
3.既能与盐酸反应又能和氢氧化钠反应的氧化物是( )
| A. | Al2O3 | B. | Fe2O3 | C. | Al(OH)3 | D. | Fe(OH)3 |
20.下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.8L0.1mol•L-1的KCl溶液 | B. | 0.2L0.2mol•L-1的HCl溶液 | ||
| C. | 0.3L0.2mol•L-1的MgCl2溶液 | D. | 0.5L 0.1mol•L-1的AlCl3溶液 |
