题目内容
16.下列说法正确的是( )| A. | 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用 | |
| B. | KNO3、KClO3与单质S、C2H5OH混搭存放在同一库房间 | |
| C. | 包装用材料聚乙烯、聚氯乙烯等都属于烃 | |
| D. | 绿色化学的核心就是治理工业生产对环境产生的污染 |
分析 A、Al2(SO4)3与NaHCO3两溶液混合后,互相促进水解反应;
B、KNO3、KClO3有强氧化性,S、C2H5OH具有还原性、易燃性;
C、烃是只含碳氢两种元素的化合物;
D、绿色化学的核心是提高原子利用率,减少污染.
解答 解:A、泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,互相促进水解生成氢氧化铝和二氧化碳,喷出大量泡沫,起到灭火作用,和胶体无关,故A正确;
B、KNO3、KClO3有强氧化性,单质S、C2H5OH易燃烧,放在一起可能发生爆炸,故B错误;
C、烃是只含碳氢两种元素的化合物,聚氯乙烯塑料中含氯元素,不属于烃,故C错误;
D、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,而不是产生污染再治理,故D错误,
故选A.
点评 本题考查知识点较多,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,涉及知识面广,难度不大.

练习册系列答案
相关题目
6.将铁、铝的混合物加入到足量氢氧化钠溶液中,充分反应后过滤,再将过滤得到的固体加入到足量的硫酸铜溶液中,充分反应后过滤得到的固体质量正好与原固体质量相等,则原固体中铝的质量分数为( )
| A. | 14.3% | B. | 12.5% | C. | 87.5% | D. | 85.7% |
7.根据图中包含的信息分析,下列叙述正确的是( )
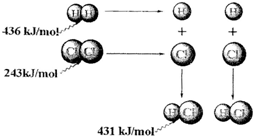

| A. | 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 | |
| B. | 436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | |
| C. | 431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量 | |
| D. | 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
4.下列叙述中正确的是( )
| A. | 分子式相同,各元素的质量分数也相同的物质是同种物质 | |
| B. | 通式相同的不同物质一定是同分异构体 | |
| C. | 分子式相同的不同物质一定是同分异构体 | |
| D. | 相对分子质量相同的不同物质一定是同分异构体 |
11.NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,11.2L的乙烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键4NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
8.短周期元素X、Y、Z、W、M、N的原子序数依次增大,且X、Y、Z、W、原子序数之和为22,最外层电子数之和为16,其中X与M同主族,W与N同主族,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构.Z2X4常做火箭推进剂的燃料,X2W2为常见的18电子化合物下列说法正确的是( )
| A. | X、Y、Z、W、M、N的原子半径的大小关系为:N>M>W>Y>Z>X | |
| B. | X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | 由X、W、M、N四种元素形成的化合物的溶于水,水溶液一定呈酸性 |
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
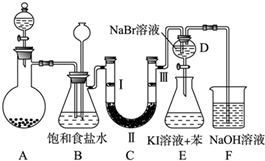
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中有水柱上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄(橙黄、橙色、橙红等)色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(5)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为14.6g.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中有水柱上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(5)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为14.6g.
4.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由大到小的顺序是( )
| A. | A、B、C、D、E | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | C、D、E、B、A |
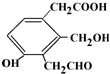 ,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.
,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.