题目内容
3. 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图可知,a、b发生固体与液体的反应,不需要加热,c中试剂除去杂质,最后利用向上排空气法收集,以此来解答.
解答 解:A.挥发的硝酸及生成的二氧化氮均与NaOH反应,则c中试剂不合理,故A错误;
B.石灰石与硫酸反应生成硫酸钙微溶,阻止反应的进一步发生,不利用二氧化碳制备,故B错误;
C.双氧水在二氧化锰作用下分解生成氧气,c中浓硫酸干燥气体,最后用向上排空气法收集,试剂均合理,故C正确;
D.碱石灰为固体干燥剂,不能放在试剂瓶中,且氨气的收集方法为向下排空气法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、制备实验、实验技能等,把握反应原理及实验装置的作用、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
相关题目
13.下列过程不涉及氧化还原反应的是( )
| A. | 古代用铜矿石、锡矿石冶炼铸造青铜器 | |
| B. | 出土后的青铜器大多数已受到锈蚀 | |
| C. | 古代用明矾溶液清除青铜镜表面的锈斑 | |
| D. | 现代用双氧水去除青铜器上有害的CuCl |
14.化学与生活和工农业生产密切相关,下列说法不正确的是 ( )
| A. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| B. | 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒 | |
| C. | 废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点 | |
| D. | 聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿 |
18.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
8.CN-可以造成水体污染,某小组采用如下方法对污水进行处理如图1.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
(5)若乙池中石墨(I)极产生无毒无害的物质,其电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为
 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.
15.在密闭容器里,2A+B?2C,其反应速率分别用vA、vB、vC表示,则( )
| A. | 2vB=3vA | B. | 3vC=2vB | C. | vB=vA | D. | vC=2vB |
5. 室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
 室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | 稀释前两溶液的Ka:MOH溶液>ROH溶液 | |
| B. | ROH的电离程度:b点小于a点 | |
| C. | 两溶液在稀释过程中,c(H+)均逐渐减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |

 ;Al
;Al ;O
;O ;C
;C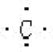 ;Cl-
;Cl- ;
; ;NaOH
;NaOH ;KBr
;KBr ;Na2S
;Na2S ;HI
;HI .
.