题目内容
5. 室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | 稀释前两溶液的Ka:MOH溶液>ROH溶液 | |
| B. | ROH的电离程度:b点小于a点 | |
| C. | 两溶液在稀释过程中,c(H+)均逐渐减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
分析 A.0.10mol/LMOH的pH=13,则MOH为强碱;
B.弱电解质在水溶液中随着浓度的减小其电离程度增大;
C.若两种溶液稀释,溶液中c(OH-)逐渐减小;
D.MOH的碱性强于ROH的碱性,当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:A.0.10mol/LMOH的pH=13,则MOH为强碱,强碱在溶液中完全电离,不存在电离平衡常数,故A错误;
B.由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故B错误;
C.若两种溶液稀释,溶液中c(OH-)逐渐减小,温度不变,Kw不变,所以c(H+)均逐渐增大,故C错误;
D.根据A知,碱性MOH>ROH,当lg$\frac{V}{{V}_{0}}$=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,则c(R+)增大,c(M+)几乎不变,所以$\frac{c({R}^{+})}{c({M}^{+})}$增大,故D正确;
故选D.
点评 本题考查弱电解质在水溶液中电离平衡,题目难度中等,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,侧重于考查学生的分析能力.

练习册系列答案
相关题目
3. 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 气体 | a | b | C | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | CO2 | 稀硫酸 | 石灰石 | 饱和NaHCO3溶液 |
| C | 02 | 双氧水 | 二氧化锰 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
4.对下列两种化合物的描述正确的是( )
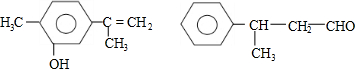
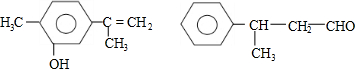
| A. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| B. | 分子中最多都有10个碳原子共平面 | |
| C. | 不是同分异构体 | |
| D. | 均能与溴水反应 |
13.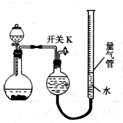 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准.
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
(2)实验Ⅲ烧瓶中发生反应的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑.
(3)实验Ⅱ中量气管中的液体最好是c(填字母).
a.浓NaOH溶液 b.氨水 c.煤油 d.饱和氯化铵溶液
(4)该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②使量气管与干燥管两端液面相平;③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
17.一定量混合物在密闭容器中发生反应mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新平衡时,B物质的浓度变为原来的1.9倍.则下列说法正确的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
14.已知25℃,四种酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
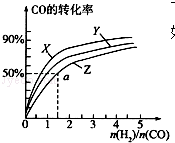 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1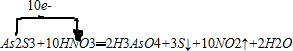 ;
;